كيمياء القياس الكيميائي: المفاهيم ، الأنواع ، أمثلة المشاكل
جار التحميل...
إن مفهوم القياس المتكافئ هو علم في الكيمياء وهو الأساس لحساب العلاقة الكمية للمواد المتفاعلة والمنتجات التي تحدث في التفاعلات الكيميائية. يقوم على معادلة رد الفعل والقوانين الأساسية.
إن خاصية التفاعلات المتكافئة هي أنه لا توجد بقايا من المواد المتفاعلة أو التفاعلات لأنها قد استُهلكت جميعًا. بشكل عام ، تم تدريس هذه المادة في الصف العاشر بالمدرسة الثانوية وغالبًا ما يتم طرحها في امتحانات مدرسية مختلفة. هنا شرح كامل.
قائمة المحتويات
المواد الكيميائية المتكافئة
تعني دراسة القياس المتكافئ الحاجة إلى فهم العديد من الأشياء ذات الصلة. بعض هذه الأشياء تشمل القوانين الأساسية للكيمياء ، والمفاهيم في الكيمياء ذات الصلة وأنواعها. هناك حاجة أيضًا إلى أسئلة الممارسة حتى يكون الفهم الذي لديهم أكثر نضجًا.
القوانين الأساسية للكيمياء لقياس العناصر الكيميائية
هناك 5 قوانين أساسية في الكيمياء من المهم معرفتها لفهم قياس العناصر الكيميائية ، بما في ذلك:
1. قانون حفظ الكتلة

في عام 1789 ، صاغ الكيميائي لافوازييه قانون حفظ الكتلة. إن جوهر قانون حفظ الكتلة هو أن الوزن الإجمالي الذي تمتلكه مادة ما سيظل كما هو ، قبل وبعد التفاعل الكيميائي.
على سبيل المثال ، لا تتغير كتلة الخشب قبل حرقها بالكتلة الناتجة عن حرق الأخشاب. بمعنى آخر ، يتم الحفاظ على كتلة المادة أو الشيء الذي امتلكته قبل وبعد حدوث التفاعل.
2. قانون المقارنة الثابتة

كان جوزيف بروست خبيرًا وضع قانون النسب الثابتة عام 1799. ينص هذا القانون على أن نسبة الوزن الإجمالي للعناصر المكونة لمركب معين لن تتغير أو تظل ثابتة.
كتوضيح ، تكون نسبة كتل المادة A والمادة B الموجودة في المحلول ثابتة دائمًا ولا تتأثر على الإطلاق بحجم المحلول.
3. قانون المقارنة المتعددة

علاوة على ذلك ، فإن القانون الأساسي للقياس المتكافئ الذي يجب فهمه هو قانون النسب المتعددة الذي وضعه جون دالتون في عام 1803. المقارنات المتعددة هي امتداد لقانون المقارنة المستمرة.
ينص قانون النسب المتعددة على أنه عندما يشكل عنصران أكثر من مركبين ، يكون وزنهما الإجمالي أحد العناصر المكونة ثابت ، ثم الوزن الإجمالي للعناصر المكونة الأخرى هو عدد صحيح بسيط.
4. قانون جاي لوساك
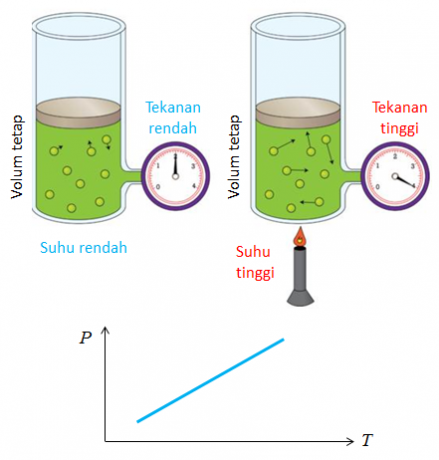
اكتشف جوزيف جاي لوساك اسمًا آخر للقانون هو قانون نسبة المجلدات. الاستنتاج الذي تم الحصول عليه من قانون مقارنة الحجم هو أن درجة الحرارة والضغط يؤثران على التغير في حجم الغاز.
5. فرضية أفوجادرو
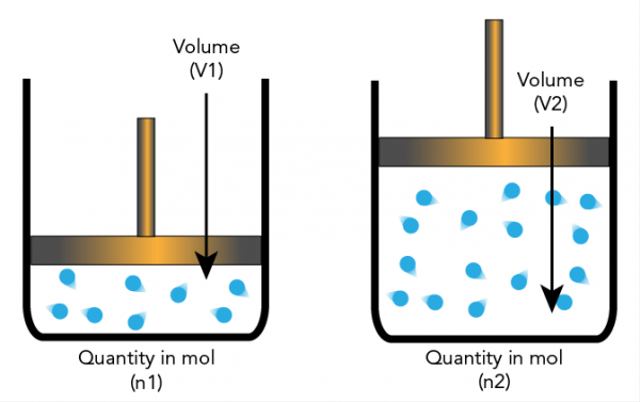
طرح Amadeo Avogadro فرضية مفادها أن الجسيمات الأولية يمكن أن تكون جزيئات وعناصر بحيث لا تكون دائمًا ذرات. هذا يؤدي إلى مزيد من التفسيرات التي يعتمد عليها قياس العناصر المتكافئة.
تنص فرضية أفوجادرو على أنه إذا كانت درجة الحرارة والضغط لهما نفس العدد ، فإن نسبة الغازات التي لها نفس الحجم سيكون لها نفس عدد الجزيئات.
اقرأ: مادة غروانية
مفاهيم كيميائية يجب فهمها في قياس العناصر الكيميائية
ليست القوانين الأساسية فقط ، بل الأشياء المهمة الأخرى التي ترتبط ارتباطًا وثيقًا بالمواد المتكافئة هي مفاهيم في الكيمياء. على الأقل ، هناك 4 مفاهيم يجب فهمها ، وهي الكتلة الذرية النسبية والكتلة الجزيئية النسبية والمولارية ومفهوم الشامات.
1. الكتلة الذرية النسبية (Ar)
في الكيمياء ، اختصار الكتلة الذرية النسبية هو Ar. يشير هذا المفهوم إلى الوزن الذري الإجمالي الذي يتم تحديده من خلال مقارنته بالوزن الكلي الذري القياسي. يستخدم الاتحاد الدولي للكيمياء البحتة والتطبيقية ذرة الكربون كمعيار للتحديد.
تم اختيار ذرة الكربون أو نظير C-12 لأنها تحتوي على نواة مستقرة وهي أكثر خاملة من الأنواع الأخرى من الذرات. يشير الخامل إلى مقاومة التفاعلات الكيميائية التي تحدث.
2. الكتلة الجزيئية النسبية (السيد)
علاوة على ذلك ، هناك مفهوم الكتلة الجزيئية النسبية التي يتم اختصارها باسم Mr. مفهوم القياس الكيميائي السيد هو الوزن الإجمالي للجزيء الذي يستخدم قياسه وحدات الكتلة الذرية.
الإعلانات
بناءً على هذا المفهوم ، فإن الجزيئات المختلفة التي لها نفس المركب لديها إمكانية وجود اختلافات في الكتلة الجزيئية لأن النظائر التي تحتويها تأتي من عناصر مختلفة.
3. مفهوم مول
تحتوي الكيمياء على وحدة حساب لتبسيط عملية الحساب ، وهي المول. يعتمد مفهوم المول على عدد أفوجادرو لتمثيل عدد الجزيئات أو الذرات أو الأيونات. وفقًا لهذا المفهوم ، فإن 1 مول يعادل 6.022 × 1023 جسيمات المادة.
يمكن القول أن كتلة الخلد الواحد تعادل Ar و Mr بالجرام. على سبيل المثال ، الوزن الإجمالي للكتلة المولية للكربون 12 جم / مول يساوي Ar من الكربون 12 amu.
4. مولارية
المولارية هي مفهوم في الكيمياء ينص على عدد مولات المذاب الموجودة في لتر واحد من المذيب. بمعنى آخر ، تشير المولارية إلى التركيز الذي تمتلكه كمية المذاب لكل وحدة حجم.
اقرأ: صيغة المولارية
أنواع القياس الكيميائي الكيميائي

يرجى ملاحظة أن هناك 3 أنواع من القياس المتكافئ وهي التفاعلات والغازات والمركبات أو التركيبات. هنا شرح كامل:
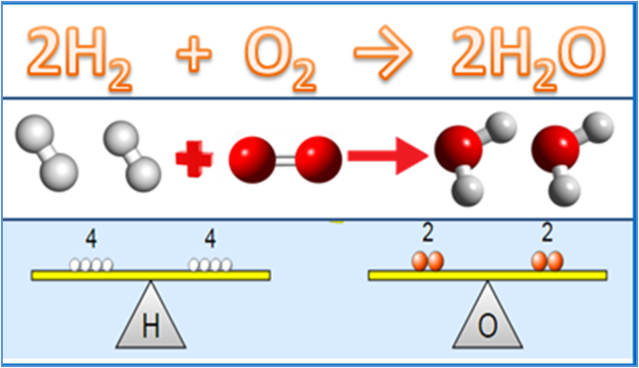
1. قياس التفاعل الكيميائي
تعريف قياس العناصر المتفاعلة هو نوع من المفاهيم التي تؤكد العلاقة الكمية بين المواد الموجودة في تفاعل كيميائي معين. يستخدم هذا المفهوم لموازنة المعادلات الكيميائية التي تحدث.
بناءً على هذا التفسير ، يمكن القول أن المواد التي تشارك في تفاعل كيميائي تؤثر على العلاقة الكمية بين هذه المواد.
2. القياس المتكافئ للغاز
بعد ذلك ، يشير القياس المتكافئ للغاز إلى مفهوم التفاعلات الكيميائية التي توجد فيها الغازات. يعتبر الغاز عند ضغط ودرجة حرارة وحجم معينين غازًا مثاليًا. يتكون الغاز من مجموعة واحدة فقط من الجسيمات تكون حركتها عشوائية ولا تتفاعل.
يتم التعبير عن معادلة الغاز المثالية بواسطة PV = n. ر. في الصيغة ، P هو الضغط في atm ، V هو حجم الغاز باللتر ، n هو عدد المولات ، T درجة حرارة 273 K و R هو الغاز 0.082 L atm / mol K.
3. قياس العناصر الكيميائية المركبة
إن تعريف قياس العناصر المتكافئة لمركب أو تركيبة هو مفهوم يعبر عن العلاقة الكمية للوزن الإجمالي أو كمية المادة التي تحتوي عليها العناصر في مركب معين.
غالبًا ما يستخدم هذا المفهوم لشرح الوزن الإجمالي للهيدروجين والنيتروجين اللذين اجتمعا لتشكيل الأمونيا المعقدة.
اقرأ: صيغة الكثافة
أمثلة على مشاكل القياس الكيميائي والمناقشة

كيفية حل المشكلات المتعلقة بقياس العناصر المتكافئة. فيما يلي مثال على سؤال ومناقشته لتسهيل فهمه:
1. أوجد عدد كل ذرة في 2 مول من H2يا!
وتجدر الإشارة إلى أن H2يحتوي O على ذرتين H و 1 O O. ثم يصبح الحل:
عدد ذرات H = 2 2 مول 6.02. 1023 ذرات / مول = 24.08. 1023 ذرة. إذن ، عدد الذرات الموجودة في 2 مول من H هو 24.08. 1023.
الآن ، فقط احسب عدد الذرات التي تمتلكها ذرة O ، وهي:
عدد ذرات O = 1 2 مول 6.02. 1023 ذرات / مول = 12.04. 1023 ذرة. بناءً على هذه الحسابات ، يمكن ملاحظة أن عدد الذرات في 2 مول من O هو 12.04. 1023.
2. احسب الوزن الإجمالي أو الكتلة التي يمتلكها 2 مول من C6ح12ا6 (جلوكوز)! ومن المعروف أيضًا أن مجموع Ar C = 12 و O = 16 و H = 1.
الحل:
من السؤال يمكن رؤية المعلومات التالية:
ن = 2 مول
السيد ج6ح12ا6 = (6 أر ج) + (12 1) + (6 16)
= 180
بعد ذلك ، يصبح الحساب:
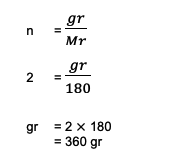
لذلك ، فإن الوزن الإجمالي 2 مول من الجلوكوز أو سي6ح12ا6 حتى 360 جرامًا بناءً على هذه الحسابات.
يعد القياس المتكافئ أحد الموضوعات المهمة في الكيمياء وهو المفهوم الأساسي للحساب لمعرفة العلاقة الكمية بين المعادلات والصيغ الكيميائية. يجب أيضًا فهم العديد من المفاهيم الأخرى في الكيمياء لأنها مرتبطة بقياس العناصر الكيميائية.
X اغلاق
الإعلانات
الإعلانات
X اغلاق
