الحرارة: الصيغ والأنواع وعينات المشكلات (ملخص)
جار التحميل...
صيغة الحرارة شيء مألوف تجده في دروس الفيزياء. الحرارة هي شكل من أشكال الطاقة التي يمكن أن يستقبلها الجسم أو يطلقها. تحتوي الحرارة على وحدات تسمى الجول أو السعرات الحرارية.
يمكن تفسير الحرارة على أنها طاقة حرارية تمتلكها مواد معينة ، ويمكن الكشف عنها بقياس درجة حرارة الجسم. يمكنك أن ترى تطبيق الحرارة على الماء الدافئ الذي يُترك مفتوحًا ، ويبرد تدريجيًا (لم يعد دافئًا بعد الآن) لأن الحرارة تنطلق من الماء إلى الهواء.
قائمة المحتويات
تعريف السعرات الحرارية

الحرارة هي الطاقة التي يمكن أن تنتقل من جسم ذي درجة حرارة أعلى إلى جسم ذي درجة حرارة أقل عندما يتلامس الجسمان مع بعضهما البعض أو يجتمعان معًا. جسمان بدرجات حرارة مختلفة سيتسببان في تدفق الحرارة وتحركها.
على سبيل المثال ، عند مزج الماء الساخن والماء البارد ، يصبح الماء الذي يجمع بين الماء الدافئ. عليك أيضًا أن تفهم أن درجة الحرارة والحرارة شيئان مختلفان. درجة الحرارة هي قيمة يمكن قياسها بميزان حرارة ، بينما الحرارة هي الطاقة التي تتدفق.
وفقًا للنظام الدولي (SI) أو MKS ، فإن وحدة الحرارة هي Joule (J) ، بينما وفقًا لـ CGS ، فإن وحدة الحرارة هي erg. بالنسبة لعدد من أنواع الطعام ، تستخدم الحرارة وحدة السعرات الحرارية.
يتم تعريف السعرات الحرارية على أنها كمية الطاقة الحرارية المطلوبة لرفع درجة حرارة 1 جرام من الماء إلى درجة واحدة مئوية. لذلك ، يمكن استنتاج أن 1 سعر حراري = 4.184 جول أو تقريبه بشكل عام مباشرة إلى 4.2 J.
صيغة السعرات الحرارية
وفقًا لتعريف الحرارة الذي قرأته أعلاه ، فيما يلي بعض الصيغ التي تم تلخيصها فيما يتعلق بالمواد الحرارية في موضوعات الفيزياء.
1. صيغة نقل الحرارة
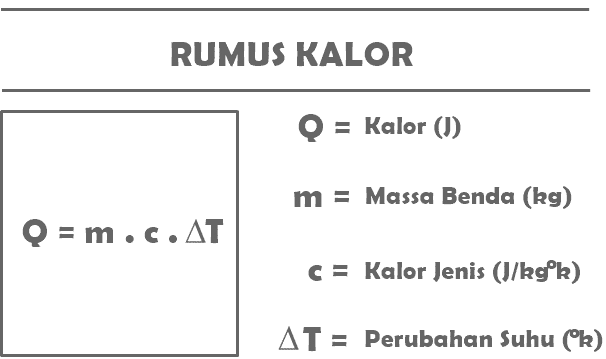
س = م. ج. تي
مع:
س = مقدار الحرارة المتلقاة أو المنبعثة من جسم معين (J)
م = كتلة الجسم الذي يتلقى أو يطلق الحرارة (كجم)
ج = الحرارة النوعية للمادة (J / كجم درجة مئوية)
T = التغير في درجة الحرارة (° C)
2. صيغة حرارية محددة
معيار هذه الصيغة هو صيغة نقل الحرارة ، عن طريق إزالة العنصر c (حرارة معينة للمادة) ليتم حسابها رياضيًا كالمعتاد.
ج = س / (م. تي)
مع:
ج = الحرارة النوعية للمادة (J / كجم درجة مئوية)
س = مقدار الحرارة المتلقاة أو المنبعثة من جسم معين (J)
م = كتلة الجسم الذي يتلقى أو يطلق الحرارة (كجم)
T = التغير في درجة الحرارة (° C)
3. صيغة السعة الحرارية
ج = س / ت
مع:
C = السعة الحرارية (J / ° K)
س = الكثير من الحرارة (J)
T = التغير في درجة الحرارة (كلفن / كلفن)
4. صيغة لتحديد السعة الحرارية
ج = م. ج
مع:
C = السعة الحرارية (J / ° K)
م = كتلة الجسم الذي يتلقى أو يطلق الحرارة (كجم)
c = الحرارة النوعية للمادة (J / kg · K)
5. حرارة الصهر وتركيب البخار
صيغة حرارة الانصهار هي كما يلي.
س = م. إل
صيغة حرارة البخار كما يلي.
س = م. يو
مع:
س = الكثير من الحرارة (J)
م = كتلة الجسم (كجم)
L = حرارة الانصهار (J / كجم)
U = حرارة بخار المادة (J / كجم)
اقرأ: الديناميكا الحرارية
أنواع السعرات الحرارية

هناك عدة أنواع من الحرارة يتم تمييزها بناءً على عملية العمل في مادة معينة. فيما يلي أنواع الحرارة التي تحتاج إلى فهمها لتتمكن من رؤية كيفية تطبيقها في الحياة اليومية.
1. حرارة التكوين (ΔHf)
حرارة التكوين هي الحرارة الناتجة أو المطلوبة لتكوين مول واحد من المركب في عناصره ، مثل الغازات ، والتي تتم كتابتها باستخدام الصيغة الجزيئية. بعض الأمثلة على حرارة التكوين هي C12يا2، ر2، ح2.
2. حرارة التحلل (ΔHd)
حرارة التحلل هي شكل الحرارة الناتجة أو المطلوبة لتحطيم مول واحد من مركب إلى عنصر آخر.
3. حرارة الاحتراق (ΔHc)
حرارة الاحتراق هي الحرارة المكتسبة أو اللازمة لحرق مول واحد من مادة ، مثل عنصر أو مركبها.
4. حرارة التحييد (ΔHn)
حرارة التعادل هي نوع الحرارة التي يتم الحصول عليها أو المطلوبة لتكوين مول واحد من H2O من التفاعل بين حمض وقاعدة. هذه الحرارة هي تفاعل طارد للحرارة لأن هناك زيادة في درجة الحرارة.
5. حرارة الذوبان (ΔHs)
حرارة الذوبان هي نوع الحرارة الناتجة أو المطلوبة لإذابة مول واحد من مادة كانت صلبة في الأصل في محلول.
اقرأ: صيغة الكثافة
السعة الحرارية والحرارة النوعية
تحتاج أيضًا إلى معرفة أن الحرارة يمكن أن تتدفق في مادتين لهما جزيئات مختلفة من المادة وتغيرات درجة حرارة مختلفة. على سبيل المثال ، عندما يتم تسخين الماء والزيت إلى نفس درجة الحرارة ، تتغير درجة حرارة الزيت أكثر من تغير درجة حرارة الماء.
يمكن أن يحدث هذا بسبب وجود أنواع مختلفة من الحرارة في جسمين يتم تجميعهما معًا أو تجميعهما معًا. الحرارة النوعية هي كمية الحرارة المطلوبة لرفع درجة الحرارة من 1 كجم من الكتلة إلى 1 درجة مئوية ، الوحدة هي السعرات الحرارية / جرام درجة مئوية أو J / كجم درجة مئوية.
كل مادة لها حرارة خاصة بها وهناك اختلافات فيها. وفي الوقت نفسه ، فإن فكرة السعة الحرارية هي مقدار الحرارة اللازمة أو الممتصة لتكون قادرة على رفع درجة حرارة الجسم إلى 1 درجة مئوية.
تغيير الحرارة
في تطبيقه ، تعمل الصيغة الحرارية باستخدام المبدأ الذي يغير مادتين يتم جمعهما معًا أو على اتصال مع بعضهما البعض. يوجد أدناه تغير في الحرارة يحدث عندما تكون هناك مواد مجمعة أو مجمعة معًا.
1. يمكن للحرارة تغيير درجة حرارة المادة
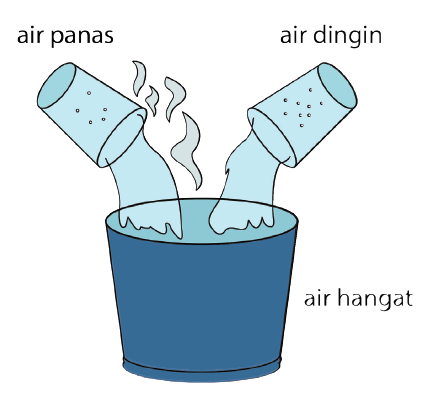
كل جسم أساسي له درجة حرارة أقل من الصفر المطلق ، لذلك يجب أن يكون للجسم حرارة. سيحدد هذا المحتوى لاحقًا مقدار الحرارة في درجة حرارة الجسم.
عندما يسخن الجسم ، سيحصل على حرارة إضافية. سترتفع درجة الحرارة أيضًا أو تزيد. على العكس من ذلك ، إذا تم تبريد الجسم ، فسوف تنبعث الحرارة وتتسبب في انخفاض درجة الحرارة.
2. يمكن للحرارة تغيير المواد

في بعض أنواع الكائنات ، عند إعطائه حرارة في وحدات معينة ، يمكن أن يخضع الجسم لتغيير الحالة. على سبيل المثال ، إذا تم تسخين الثلج (تسخينه) ، فسوف يتغير شكل الجليد من صلب إلى سائل أو حتى غاز.
إذا تم إجراء عملية التسخين بشكل مستمر ، فإن هذا هو ما يتسبب في تغيير الماء من شكله مرة أخرى إلى مادة. يحدث هذا عندما يتحرك الكائن الذي على وشك تغيير شكله من نقطة السائل إلى نقطة انصهار الكائن.
أنواع انتقال الحرارة
بعد الاطلاع على شرح للتعريف وأنواع وصيغ الحرارة والتغيرات في الحرارة ، يمكنك أن تستنتج أن الحرارة يمكن أن تتحرك أيضًا عندما تلتقي أو تتلامس مع أشياء أخرى. فيما يلي بعض أنواع نقل الحرارة.
1. التوصيل

يحدث انتقال الحرارة عن طريق التوصيل عند المرور عبر مادة وسيطة مثل المعدن ، ولكن لا يتبعه حركة دائمة للجسيمات في المادة. على سبيل المثال ، عندما تقوم بتسخين أحد طرفي المعدن ، فإن الطرف الآخر من المعدن يسخن أيضًا.
هذا بسبب انتقال الحرارة من درجة حرارة عالية إلى درجة حرارة منخفضة. سوف يتسبب الطرف المعدني المسخن في إحداث اهتزازات في الجزيئات المعدنية الأخرى المرتبطة بها.
لذلك ، تهتز جميع الجزيئات المعدنية حتى لو تم تسخين طرف واحد فقط من المعدن ، مما يؤدي بعد ذلك إلى انتقال الحرارة. مثال آخر هو عندما يكون عادم الدراجة النارية ساخنًا عند تشغيل المحرك.
يحدث التوصيل أيضًا عندما تقوم بإشعال الألعاب النارية ، وإمساك غطاء وعاء ساخن أثناء عملية الطهي ، والزبدة التي تذوب عند تسخينها ، وما إلى ذلك. صيغة نقل الحرارة للتوصيل هي كما يلي.
معدل الحرارة = Q / t = kA. تي / س
2. الحمل
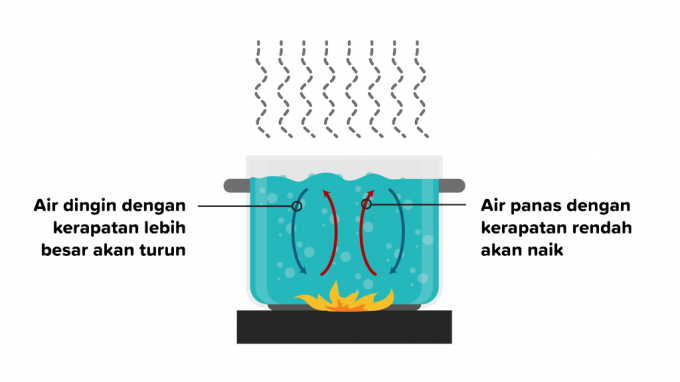
الحمل الحراري هو انتقال الحرارة الذي تمر فيه الحرارة عبر مادة ما ويتبعها حركة أجزاء من المادة. يمكن أن يحدث انتقال الحرارة بالحمل في سوائل أو غازات ، لذلك ينقسم الحمل الحراري إلى قسمين على النحو التالي.
أ. الحمل الحراري
الحمل الحراري هو انتقال الحرارة الذي يحدث بسبب الطفو بدون عوامل خارجية ويتأثر بأنواع مختلفة من الأجسام. مثال على ذلك هو عند تسخين الماء ، فإن كثافة جزيئات الماء الساخن ستبتعد عن النار ، ثم تحل محلها مادة مائية ذات درجة حرارة منخفضة.
ب. الحراري الجبري
الإعلانات
الحمل الحراري هو انتقال حراري ناتج عن تأثير عوامل خارجية ، مثل الضغط ، بحيث يحدث النقل عمدًا أو قسريًا. وهذا يعني أن الحرارة تضطر للانتقال إلى مكان بسبب المساعدة.
أمثلة على الحالات هي عندما تنتج مروحة الهواء البارد إلى مكان يشعر بالحرارة ، ونظام تبريد المحرك في رادياتير السيارة ، وما إلى ذلك.
يحدث تطبيق آخر للحمل الحراري عند تسخين الماء ، حيث توجد حركة صعود وهبوط للمياه ، بذور الفاصوليا الخضراء التي ترتفع وتنخفض عند الغليان ، عملية نسائم البر والبحر ، حركة بالونات الهواء الساخن ، دخان المدخنة. مصنع.
صيغة نقل الحرارة بالحمل الحراري هي كما يلي.
معدل الحرارة = Q / t = hA. تي
3. إشعاع

الإشعاع هو نقل الحرارة الذي لا يتطلب مادة أو وسيطًا. يختلف انتقال الحرارة في الإشعاع عن التوصيل والحمل الحراري. لا يؤدي النزوح في الإشعاع دائمًا إلى اتصال المادتين أو التقاءهما ، لأن الحرارة يمكن أن تنتقل حتى بدون وسيط.
أي أن الحرارة ستشع في جميع الاتجاهات بواسطة مصدر الحرارة نفسه ، ثم تتدفق في جميع الاتجاهات التي يمكن تحقيقها. في الأساس ، يمكن لجميع الأجسام أن تنبعث وتمتص الإشعاع الحراري ، لكن الكمية تعتمد على درجة حرارة ولون المادة.
كلما زادت درجة حرارة الجسم عن درجة الحرارة المحيطة به ، زادت الحرارة التي يشعها إلى محيطه. لذلك ، إذا كانت مساحة سطح الجسم الساخن أكبر ، فإن الحرارة التي سيتم إشعاعها ستكون أكثر سخونة.
مثال على حالات الإشعاع في الحياة اليومية هو عندما تشعل النار ، ستشعر بالدفء نظرًا لوجود مصدر النار على مسافة معينة ، يتم الشعور بالإشعاع عندما تصبح راحة اليد دافئة عند الاقتراب بالنار. الصيغة الحرارية للإشعاع هي كما يلي.
معدل الحرارة = Q / t = eσAT4
4. عزل الحرارة

تتميز الحرارة بخاصية نقلها بسهولة. يمكنك منع حدوث الحركة ، سواء كان ذلك عن طريق التوصيل والحمل الحراري والإشعاع. على سبيل المثال عن طريق عزل الغرفة ؛ يمكن أن تحافظ الترمس على درجة حرارة الماء ساخنة أو دافئة ، بحيث يمكن منع انتقال الحرارة.
اقرأ: مادة الغاز
مثال على مشكلة السعرات الحرارية

الصيغة الحرارية هي طريقة يمكنك استخدامها للعمل على الأمثلة التالية من الأسئلة!
1. مثال السؤال 1
جسم ما عند درجة حرارة 5 ° C ويمتص 1500 J من الحرارة. تتغير درجة حرارة الجسم إلى 32 درجة مئوية. احسب السعة الحرارية للجسم!
المحلول:
س = 1500 ج
T = 32 درجة مئوية - 5 درجة مئوية = 27 درجة مئوية = 300 درجة مئوية
ج = س / ت
ج = 1500/300
C = 5 J / ° ك
2. مثال السؤال 2
احسب الحرارة المطلوبة لتسخين 5 كجم من الماء عند 25 درجة مئوية إلى 105 درجة مئوية إذا كان معروفًا أن الحرارة النوعية للماء هي 1000 جول / كجم درجة مئوية!
المحلول:
م = 5 كجم
ج = 1000 جول / كجم درجة مئوية
T = 105 درجة مئوية - 25 درجة مئوية = 80 درجة مئوية
س = م. ج. تي
س = 5. 1000. 80
س = 400000 ج
3. مثال السؤال 3
إذا كانت كتلة الماء 3 كجم وتم تسخينها من 30 درجة مئوية إلى 100 درجة مئوية وكانت حرارتها النوعية 1 جول / جم درجة مئوية ، فاحسب كمية الحرارة المطلوبة للماء!
المحلول:
م = 3 كجم
ج = 1 جم / درجة مئوية = 1000 جول / كجم درجة مئوية
T = 100 درجة مئوية - 30 درجة مئوية = 70 درجة مئوية
س = م. ج. تي
س = 3. 1000. 70
س = 210.000 جول
4. مثال السؤال 4
كتلة السائل ٥ كجم. يتطلب السائل حرارة 200000 J ، ويتم تسخينه من 20 درجة مئوية إلى 80 درجة مئوية. احسب الحرارة النوعية للسائل!
المحلول:
م = 5 كجم
س = 200000 ج
T = 80 درجة مئوية - 20 درجة مئوية = 60 درجة مئوية
ج = س / م. تي
ج = 200000/5. 60
ج = 200000/300
ج = 666.67 جول / كجم درجة مئوية
5. مثال السؤال 5
كتلة الألومنيوم 5 كجم. درجة الحرارة الأولية هي 25 درجة مئوية. إذا تلقى الألمنيوم 250000 J من الحرارة وكانت الحرارة النوعية 900 J / kg ° C ، فاحسب درجة الحرارة النهائية للألمنيوم!
المحلول:
م = 5 كجم
س = 250.000 ج
ج = 900 ج / كجم درجة مئوية
تي1 = 25 درجة مئوية
س = م. ج. تي
250.000 = 5. 900. (ت2 – 25)
تي2 – 25 = 250.000 / 5. 900
تي2 – 25 = 250.000 / 4.500
تي2 – 25 = 55,56
تي2 = 55.56 + 25 = 80.56 درجة مئوية
6. مثال السؤال 6
يوجد 300 جرام من الماء عند درجة حرارة 25 درجة مئوية ، سيتم تسخينها بطاقة 1500 سعرة حرارية. إذا كانت الحرارة النوعية للماء 1 كالوري / جم درجة مئوية ، احسب درجة حرارة الماء بعد تسخينه!
المحلول:
م = 300 جرام
تي1 = 25 درجة مئوية
ج = 1 كال / جم درجة مئوية
س = 1500 كالوري
س = م. ج. تي
1.500 = 300. 1. (ت2 – 25)
تي2 – 25 = 1500 / 300. 1
تي2 – 25 = 5
تي2 = 5 + 25 = 30 درجة مئوية
7. مثال السؤال 7
هناك 300 جرام من الماء ليتم تسخينها من 40 درجة مئوية إلى 65 درجة مئوية. إذا كانت الحرارة النوعية للماء هي 1 كالوري / جم درجة مئوية أو 4200 جول / كجم درجة كلفن ، احسب:
- يتم تلقي الكثير من الحرارة في السعرات الحرارية
- مقدار الحرارة التي يتم تلقيها في الجول
المحلول:
م = 300 جم = 0.3 كجم
T = 65-40 = 25 درجة مئوية
ج = 1 كالوري / جم درجة مئوية = 4200 جول / كجم درجة مئوية
- السعرات الحرارية في السعرات الحرارية
س = م. ج. تي
س = 300. 1. 25
س = 7500 سعرة حرارية
- الحرارة بالجول
س = م. ج. تي
س = 0.3. 4.200. 25
س = 31،500 سعر حراري = 132،300 جول
بناءً على الشرح أعلاه ، لا تدور صيغة الحرارة فقط حول الإفراج والمطالبة الحرارة ، ولكن هناك تغيير في الحرارة ، ونقل الحرارة ، وحتى الحرارة النوعية لكل مادة يتغير. أتمنى أن تكون هذه المقالة مفيدة!
X اغلاق
الإعلانات
الإعلانات
X اغلاق
