مادة العدد الكمي: الأنواع ، أمثلة على المشكلات (ملخص)
جار التحميل...
عندما يتم شرح ذلك ببساطة ، فإن الرقم الكمي هو رقم يصف موضع الإلكترونات ومستويات الطاقة أو المسافة من النواة الذرية في وقت واحد ، وشكل المدارات ، واتجاه المدارات ، ودوران الإلكترونات الموجودة في النموذج الذري الميكانيكي الكم.
كل ذرة لها مدار ، والمدارات الذرية لها مستويات طاقة مختلفة. سيكون لمستوى الطاقة في نفس المدار مستوى طاقة مختلفًا إذا كانت الذرات مختلفة ، لذا فإن مدار 1 ثانية للهيدروجين يختلف في مستوى الطاقة عن مدار 1 ثانية للهليوم.
قائمة المحتويات
تعريف الأعداد الكمية

في الدالة الموجية ، هذا الرقم له معنى خاص لوصف حالة الوضع الكمي. يمكن لهذه الأرقام أن تصف حالة الإلكترونات في الذرة. في عام 1926 ، اقترح إروين شرودنجر نظرية ميكانيكا الكم.
تشرح هذه النظرية بنية الذرة. يتم التعبير عن هذا النموذج الذري الميكانيكي الكمومي في معادلة رياضية ، وهي معادلة الموجة. ينتج عن حل معادلة ذرة الهيدروجين دالة موجية أو مدار ذري.
سيصف هذا المدار الذري حالة العدد الكمي للإلكترونات في الذرة. يعني مربع الدالة الموجية أن هناك احتمالًا كبيرًا للحصول على إلكترون في حجم معين من الفراغ حول النواة الذرية.
كما هو الحال مع مبدأ عدم اليقين Heisenberg ، لا يمكن تحديد موضع الإلكترونات في الذرات. كل ما يمكن معرفته هو الموضع الذي من المرجح أن يوجد فيه الإلكترون.
أنواع الأعداد الكمية
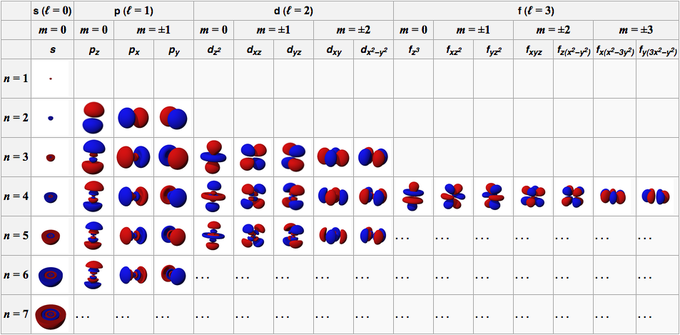
يتكون مدار الذرة من وظائف الموجة التي يتكون منها المدار. في ظل الظروف العامة ، يتم وصف الخصائص المدارية للذرة بأربعة أرقام ، وهي n و l و m و s.
1. رقم الكم الرئيسي (ن)
يتكون هذا الرقم من أعداد صحيحة موجبة تبدأ من 1 (واحد) ، مما يجعل قيمة n هي 1 ، 2 ، 3 ، 4 ، 5 ، وهكذا. يشير هذا الرقم إلى القشرة التي يشغلها مدار في الذرة.
2. رقم الكم السمت (لتر)
يتكون هذا الرقم من أعداد صحيحة موجبة تبدأ من 0 (صفر) ، مما يجعل قيمة l 0 ، 1 ، 2 ، 3 ، 4 ، 5 ، وهكذا. هذه الأرقام لها علاماتها الخاصة ؛ 0 هو المدار s ، 1 هو المدار p ، 2 هو المدار d ، و 3 هو المدار f.
3. عدد الكم المغناطيسي (م)
يتكون هذا الرقم من أعداد صحيحة تبدأ من 0 (صفر) إلى +/- 1 ، وبالتالي فإن قيمة الرقم لكل مدار ليست هي نفسها. بالنسبة إلى المدار s ، فإن m تساوي 0 لأنها تقع في المدار s ، ثم l تساوي 0. ومع ذلك ، بالنسبة إلى المدارات d حيث l هي 2 ، فإن m تساوي -2 ، -1 ، 0 ، 1 ، و 2.
4. عدد (أرقام) الدوران الكمي
إذا كان الرقم السابق يشير إلى اتجاه المدارات ، فإن هذا الرقم يصف دوران الإلكترون الذي قيمته 1/2 و -1 / 2.
اقرأ: ميكانيكا الكم
المدارات والأرقام الكمية
يحتوي كل مدار ذري على مجموعة فريدة من ثلاثة أرقام كمومية. هذه الأرقام هي الرقم الكمي الرئيسي (ن) ، والسمت أو الزخم الزاوي (ل) ، والمغناطيسية (م). توضح هذه الأرقام الثلاثة عدة أشياء.
وتشمل هذه وصف مستوى الطاقة في المدارات ، والحجم ، والشكل ، واتجاه التوزيع الشعاعي المحتمل للمدارات الذرية. ثم هناك عدد (أرقام) الدوران ، وهو رقم يخبرك بتدوير الإلكترون في مدار.
الشكل المداري الذري
هناك أربعة أشكال من المدارات الذرية بناءً على قيم عدد السمت الخاصة بهم. الأشكال المدارية الأربعة هي كما يلي.
1. المدارات
المدار s هو مدار مع l = 0. إنه كروي الشكل ، مع نواة الذرة في المركز. نظرًا لأن الكرة لها اتجاه واحد فقط ، فإن جميع المدارات S لها قيمة واحدة فقط من m ، أي m = 0. يحتوي مدار 1s على أعلى كثافة أو كثافة إلكترون في نواة الذرة.

ثم تتناقص الكثافة الذرية ببطء أثناء تحركها بعيدًا عن النواة الذرية. يحتوي مدار 2s على منطقتين ذات كثافة إلكترون عالية. من المنطقتين ، توجد عقدة كروية ، حيث تقل احتمالية مواجهة الإلكترونات في تلك المنطقة إلى الصفر.
سيستمر نمط زيادة الرؤوس المدارية s مع 4s و 5s وهكذا.
2. ص.المدارات
المدار p هو مدار مع l = 1. الشكل يشبه البالون الملتوي ، مزود بفصين. يوجد الفصوص على جانبي نواة الذرة. تقع النواة الذرية في مستوى العقدة المدارية p ، بين فصين بكثافة إلكترون عالية.

يحتوي المدار p على ثلاثة أنواع من التوجه المكاني ، وهي Px و Py و Pz ، لذلك توجد ثلاث قيم محتملة لـ m ، وهي -1 أو 0 أو +1. المدارات الثلاثة متعامدة مع بعضها البعض على المحاور x و y و z في الإحداثيات الديكارتية. الشكل والحجم والطاقة متماثلان.
3. د المداري
المدار d هو مدار مع l = 2. هذا المدار له خمسة اتجاهات مختلفة ، مما يمنحه خمس قيم محتملة لـ m ، وهي -2 ، -1 ، 0 ، +1 ، أو +2. المدارات الأربعة d منها dxy و dxz و dyx و d2-ص2.
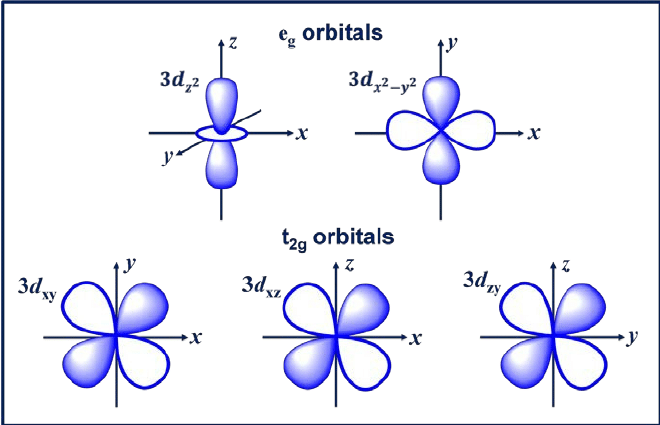
تحتوي هذه المدارات على أربعة فصوص على شكل ورقة البرسيم. المدار d التالي هو dzث، والتي تحتوي على فصين رئيسيين على المحور z وقسم واحد على شكل دونات في المنتصف.
4. و. المدارات
المدار f هو مدار مع l = 3. يحتوي هذا المدار على سبعة أنواع من الاتجاه ، تمامًا كما توجد سبع قيم محتملة لـ m (2l + 1 = 7). جميع المدارات f لها أشكال معقدة بأعداد متفاوتة من الفصوص.
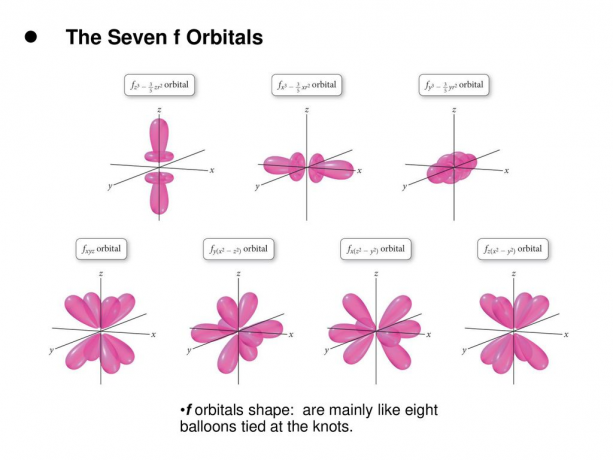
اقرأ: التوزيع الإلكترون
التوزيع الإلكترون
بعد أن تفهم كيف العلاقة بين وجود الإلكترونات في الذرات والمدارات في النظرية الذرية لميكانيكا الكم ، بعد ذلك سوف تتعلم عن تكوين الإلكترونات ، وكيفية ترتيب الإلكترونات في المدارات في الأصداف الذرية متعدد الإلكترون.
1. قاعدة أوفباو
الإعلانات
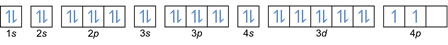
في هذه القاعدة ، يُنص على أنه يجب ملء الإلكترونات من مستويات طاقة منخفضة إلى أعلى. يمكن رؤية مستويات الطاقة في المدارات في ترتيب الذرات في الجدول الدوري للعناصر الكيميائية.
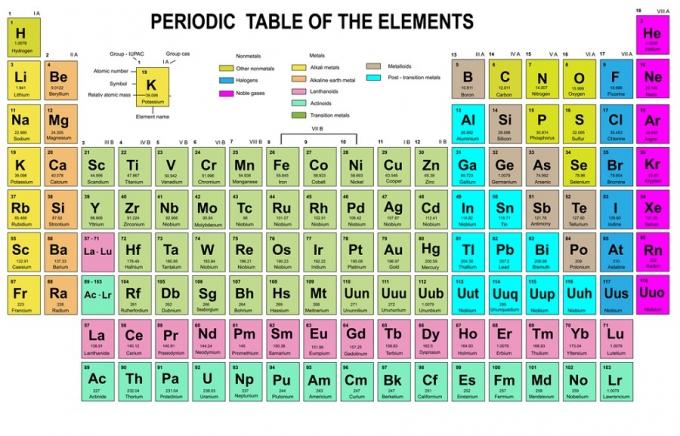
في الجدول ، أسفل اليسار مكتوب باللون الأحمر حيث توجد كتلة s ، والأزرق للكتلة d ، والأصفر للكتلة p ، والأخضر للكتلة f. بينما كل صف عبارة عن جلد.
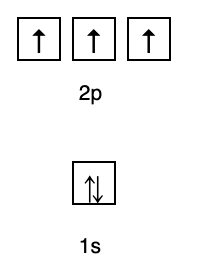
بناءً على هذا الترتيب ، يمكنك أن ترى أن ترتيب مستويات الطاقة هو 1s و 2 s و 2 p و 3 s و 3 p و 4 s و 3 d و 4 p وما إلى ذلك.
2. قواعد هوند
تنص هذه القاعدة على أنه إذا كانت هناك مدارات على نفس مستوى الطاقة ، فيجب أن تكون الإلكترونات تمتلئ بالتوازي حتى تمتلئ جميع المدارات في نفس مستوى الطاقة بالإلكترونات ، كما هو موضح في الشكل التالية.
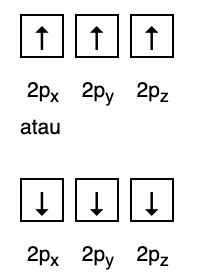
وفي الوقت نفسه ، فإن الشكل التالي لا يتوافق مع التعبئة بموجب قاعدة هوند.
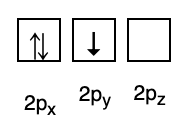
3. حظر باولي
ينص حظر باولي على أن الإلكترونات لا يمكن أن يكون لها نفس العدد الكمي عند ملؤها في مدار ، لذلك يوجد رقم (أرقام) دوران بقيمة +1/2. أقل طاقة هي التي تحتوي على أكبر عدد من الإلكترونات المقترنة والدوران المتوازي.
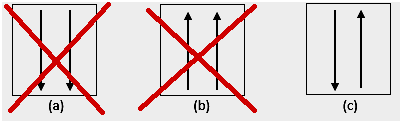
4. شذوذ

وفقًا للتجارب ، هناك حالات شاذة في تكوين الإلكترون وفقًا للقواعد المذكورة أعلاه. عادة ما تكون الطبقة الفرعية d نصف ممتلئة أو ممتلئة. على سبيل المثال ، ل 24Cr ، تكوينه الإلكتروني: [Ar] 4s1 3d5 ، أكثر استقرارًا من [Ar] 4s2 3d4.
بالإضافة إلى ذلك ، فإن تكوين الإلكترون لـ 29Cu: [عربي] 4s1 ثلاثي الأبعاد10، أكثر استقرارًا من [Ar] 4s2 ثلاثي الأبعاد9. وفي الوقت نفسه ، فإن تكوين الإلكترون للأيونات أحادية الذرة مثل K+، نا+، كاليفورنيا2+، ر–، س2-، وهكذا يمكن تحديده بواسطة الذرة المحايدة أولاً.
للكاتيونات أو الأيونات موجبة الشحنة ، أحادي الذرة أx + بشحنة x + ، يتم إزالة عدد من الإلكترونات x من غلاف الإلكترون الخارجي للذرة المحايدة A. أما الأنيون ، أحادي الذرة بص- بشحنة y ، يتم التقاط عدد من الإلكترونات y في مدار أقل طاقة لم يمتلئ بعد.
كيفية تحديد أرقام الكم
قبل تحديد الرقم ، يجب عليك أولاً إجراء التكوين الإلكتروني للعنصر الذي تريد إيجاد القيمة الكمية له. على سبيل المثال 16س. تكوينه الإلكتروني هو 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص4. بعد ذلك ، خذ تكوين الإلكترون الأخير ، وهو 3p4.
- بناءً على هذا التكوين ، تكون قيمة الرقم الرئيسي هي 3 ، لأن الرقم 3 يمثل حجم المدار أو الغلاف.
- p هي قشرة فرعية للإلكترون ، لذلك يمكن الحصول عليها تحت قيمة l = 1.
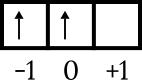
- نظرًا لوجوده في p subshell ، سيكون الرقم الكمي بين -1 أو 0 أو +1. عند تحديده ، ارسم الصندوق المداري أولاً. يمكنك استخدام الأسهم عند ملء الصندوق.
- املأ كل مربع بسهم يشير لأعلى ، ثم املأه بسهم يشير لأسفل. الرقم 4 هو عدد الأسهم التي يجب ملؤها ، ليتم الحصول عليها بعد ذلك على هذا النحو.
↑↓ ↑ ↑
-1 0 +1
- السهم الرابع (الأخير) موجود في المربع -1 ، حيث تكون القيمة الميكانيكية م = -1.
- السهم لأعلى يساوي +1/2 ، بينما السهم لأسفل يساوي -1/2. السهم الأخير هو السهم الذي يشير إلى الأسفل ، وبالتالي فإن قيمة s = -1/2.
حسنًا ، هذه هي طريقة تحديد العدد الكمي. فيما يلي بعض الأمثلة على الأسئلة المتعلقة بهذه المادة لتقوم بدراستها.
اقرأ: التغيير الجسدي
أمثلة على أرقام الكم

تحقق من الأسئلة التالية!
1. مثال السؤال 1
تحديد تكوينات الإلكترون ومخططات الإلكترون للعناصر والأيونات أحادية الذرة التالية!
- 8ا2-
- 20ملغ2+
- 26الحديد3+
- 27شارك
- 32Ge
المحلول:
- التوزيع الإلكترون 8O2: 1s2 2 ثانية2 2 ص4 أو [هو] 2 ثانية2 2 ص4
التوزيع الإلكترون 8O2–: 1 ثانية2 2 ثانية2 2 ص6 أو [هو] 2 ثانية2 2 ص6 أو [ني] (بالإضافة إلى إلكترونين: 2 ثانية2 2 ص4+2)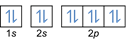
- التوزيع الإلكترون 20ملغ: 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 أو [Ar] 4s2
التوزيع الإلكترون 20ملغ2+: 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 أو [Ar] (اطرح 2 إلكترون من الغلاف الخارجي: 4s2-2)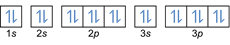
- التوزيع الإلكترون 26Fe: 1s2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد6 أو [Ar] 4s2 ثلاثي الأبعاد6
التوزيع الإلكترون 26الحديد3+: 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 ثلاثي الأبعاد5 أو [Ar] 3d5 (اطرح 3 إلكترونات من الغلاف الخارجي: 4 ثانية2-2 ثلاثي الأبعاد6-1)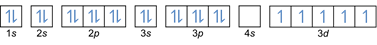
- التوزيع الإلكترون 27شارك: 1s2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد7 أو [Ar] 4s2 ثلاثي الأبعاد7
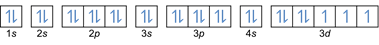
- التوزيع الإلكترون 32Ge: 1s2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد10 4 ص2 أو [Ar] 4s2 ثلاثي الأبعاد10 4 ص2
2. مثال السؤال 2
الإلكترون الأخير في Ga له رقم كمي ...
- ن = 4 ؛ ل = 0
- ن = 4 ؛ ل = 1
- ن = 3 ؛ ل = 2
- ن = 4 ؛ ل = 2
- ن = 3 ؛ ل = 1
المحلول:
إذا نظرت إلى الجدول الدوري الكيميائي للعناصر ، فإن العنصر Ga موجود في الفترة IV ، مما يعطيها n = 4. الغاليوم موجود في المجموعة 13 ، لذا فإن إلكترونات التكافؤ موجودة في p subshell ، أي l = 1.
3. مثال السؤال 3
أدناه ، الرقم الكمي الذي لا يمكن أن يشغله آخر إلكترون من Cl atom ، هو ...
- ن = 3 ؛ ل = 1 ؛ م = -1 ؛ ق = -1/2
- ن = 3 ؛ ل = 1 ؛ م = 0 ؛ ق =
- ن = 3 ؛ ل = 2 ؛ م = -1 ؛ ق =
- ن = 3 ؛ ل = 2 ؛ م = 1 ؛ ق = -1/2
- ن = 3 ؛ ل = 1 ؛ م = 1 ؛ ق = 1/2
المحلول:
نظرًا لأن العنصر Cl في الفترة 3 ، فإن n = 3. Cl هي أيضًا مجموعة 17 ، لذا فإن إلكترونات التكافؤ موجودة في p subshell ، لذلك l = 1. يمكن أن تكون قيمة m -1 ، 0 ، أو +1 لأن طاقات الأرقام الكمية الثلاثة هي نفسها ولا يهم ترتيب الملء.
يمكن أن تساوي s أيضًا -1/2 أو 1/2 ، لذلك لا يمكننا تحديد m و s على وجه اليقين.
4. مثال السؤال 4
عنصر X3+ له نفس تكوين الإلكترون مثل العنصر Ar. إذن ، الأيون الذي له نفس تكوين الأيون هو ...
- ك+
- ملغ2+
- نا+
- Cl+
- F–
المحلول:
يقع العنصر Ar في الفترة 3 ، لذا فإن الأيون له نفس تكوين الإلكترون مثل Ar أو [Ne] 3s2 3 ص6 سيكون في الفترة 4 للكاتيونات وفي الفترة 3 للأنيونات. أنسب أيون هو K+.
5. مثال السؤال 5
حدد الرقم الكمي للعنصر 32جنرال الكتريك!
المحلول:
التوزيع الإلكترون 32Ge: 1s2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد10 4 ص2 أو [Ar] 4s2 ثلاثي الأبعاد10 4 ص2.
التكوين الأخير هو 4p2. مستوى الطاقة هو 4 ، وهو في p subshell ، لذلك n = 4 و l = 1. 4 ص.رسم الرسم التخطيطي المداري2 لمعرفة الأرقام الأخرى على النحو التالي.
يوجد الإلكترون الأخير في المربع المداري 0 ، والسهم يشير لأعلى ، لذا م = 0 و s = +1/2.
6. مثال السؤال 6
يُسمح بكل ما يلي بالأرقام الكمية ، باستثناء ...
- ن = 2 ؛ ل = 1 ؛ م = -1
- ن = 3 ؛ ل = 2 ؛ م = 1
- ن = 3 ؛ ل = 3 ؛ م = -1
- ن = 3 ؛ ل = 0 ؛ م = 0
- ن = 3 ؛ ل = 2 ؛ م = -1
المحلول:
إذا كانت قيمة الرقم الرئيسي (n) هي 3 ، فإن الحد الأقصى لعدد السمت (l) هو n-1 = 3-1 = 2. لذلك ، لا يُسمح بالخيارات C مع n = 3 و l = 3 و m = -1.
لتعلم الأرقام الكمومية ، تحتاج أيضًا إلى إتقان بعض الأعداد الذرية للعناصر التي غالبًا ما تستخدم أو تظهر في المسائل. بالإضافة إلى ذلك ، يجب أن تكون على دراية بترتيب مستويات الطاقة عند إنشاء تكوينات إلكترونية.
X اغلاق
الإعلانات
الإعلانات
X اغلاق
