أمثلة على صيغ المولارية والمولودية
جار التحميل...
الطبيعة التجميعية للحل هي إحدى المواد الكيميائية في الفئة XI SMA. لفهم هذه المادة ، يجب أن تتقن معادلات المولارية والمولارية للحل جيدًا لأن هذا الفصل له علاقة وثيقة بتركيز الحل.
بالنسبة لأولئك الذين لا يعرفون ، الحل هو خليط متجانس من المذيبات (عادة الماء أو H.2س) مع المادة المذابة. لتسهيل فهم هذه المادة ، نقدمها هنا من الفهم إلى أمثلة على الأسئلة حول مولارية الحل.
قائمة المحتويات
فهم المولودية

المولارية هي مقياس للذوبان الذي يعبر عن عدد مولات المذاب لكل حجم من المحلول. رمز المولارية هو الرمز M (كبير) مع كون الوحدات المولية مكافئة للمولات / لتر.
اقرأ: قاعدة حمضية
صيغة المولارية

إذا كان فهم المولارية سابقًا ، فماذا عن الصيغة؟ حسنًا ، ها هي صيغة المولارية:
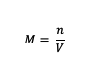
M = مولارية المادة (مولار أو مول / لتر)
ن = مولات مادة (مولات)
V = حجم المحلول (مل)
بالإضافة إلى الصيغة أعلاه ، يمكنك أيضًا حساب المولارية باستخدام الصيغة التالية:
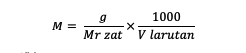
M = مولارية المادة (مولار أو مول / لتر)
ز = كتلة المادة (جرام)
السيد = الكتلة الجزيئية النسبية للمادة (جرام / مول)
V = حجم المحلول (مل)
إذا كان المحلول مختلطًا ، تنطبق الصيغة:
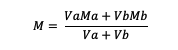
Va = حجم المادة أ
Vb = حجم المادة ب
أماه = مولارية المادة أ
ميغابايت = مولارية المادة ب
إذا تم تخفيف المحلول ، فإن صيغة المولارية المطبقة هي كما يلي:
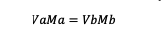
Va = حجم المادة أ
Vb = حجم المادة ب
أماه = مولارية المادة أ
ميغابايت = مولارية المادة ب
من أجل الحصول على قيمة المولي ، عليك حسابها باستخدام الصيغة أدناه:
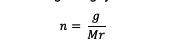
ن = مولات مادة (مولات)
ز = كتلة المادة (جرام)
السيد = الجزيء النسبي للمادة (جرام / مول)
تعريف المولالية

مشابه للوهلة الأولى ، لكن مولارية مختلفة أنت تعرف مع مولالي!
المولي أو التركيز المولي هو عدد مولات المذاب لكل كيلوغرام واحد من المذيب. بحكم التعريف ، المولالية هي كمية تحدد عدد مولات المذاب لكل وحدة وزن للمذيب. يُشار إلى المولالية بالرمز m (صغير).
اقرأ: قانون أوم
صيغة مولالي

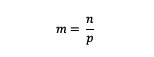
م = مولالية مادة (مولالية)
ن = مولات مادة (مولات)
ع = كتلة المذيب (جرام)
بالإضافة إلى ذلك ، يمكنك أيضًا حساب المولودة باستخدام الصيغة التالية:
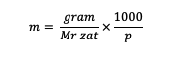
م = مولالية مادة (مولالية)
السيد = الجزيء النسبي للمادة (جرام / مول)
ع = كتلة المذيب (جرام)
الفرق بين صيغ المولارية والمولودة
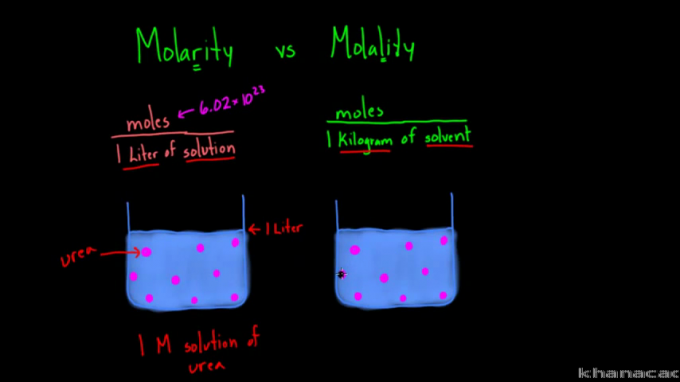
غالبًا ما تجعل المصطلحات "مولارية" و "مولالية" بعض الناس في حيرة من أمرهم بسبب تشابه كتابتهم ونطقهم. على الرغم من استخدام كليهما لقياس تركيز المحلول ، إلا أن هناك اختلافات بينهما.
بناءً على الصيغة أعلاه ، يمكن ملاحظة أن الفرق بين المولارية والمولالية يكمن في النهج. تقيس المولارية أو التركيز المولي عدد مولات المادة لكل لتر من المحلول. بينما تقيس المولالية عدد مولات المادة لكل كيلوغرام من المذيب.
الإعلانات
اقرأ: صيغة الأعمال
أمثلة على مشاكل المولودية والمناقشة

الآن ، بعد معرفة صيغة المولارية والموالية ، سيكون من الأفضل إذا حاولت على الفور العمل على حل المشكلة لفهم المادة بشكل أفضل. تعال ، فقط قم بالأسئلة التالية!
مشكلة المولارية
1. إذا كان معروفًا أن كتلة المذاب 11 جرامًا ، فإن حجم المحلول 500 مل ، والسيد = 22. ما هي المولارية؟
إجابه :
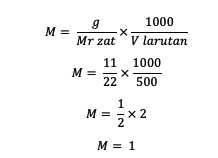
لذا ، فإن مولارية المادة هي 1 مول / لتر.
2. تم تخفيف 5 M HCl بحجم 20 مل إلى 0.4 م. إذن ، ما هي كمية الماء التي يجب إضافتها إلى المحلول؟
إجابه :
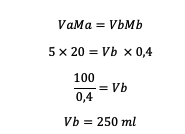
لذا فإن كمية الماء المراد إضافتها هي 250 مل.
3. الجلوكوز (سي6ح12ا6) التي لها كتلة نسبية 180 موجودة في 500 مل من محلول جلوكوز 0.1 مولار. ما هي كتلة الجلوكوز؟
إجابه :

إذن ، الكتلة التي يمتلكها الجلوكوز (C6ح12ا6) 9 جرام.
4. ما هو حجم المذيب في محلول H.2لذا4 0.2 M الذي يكون المذاب 0.3 مول؟
إجابه :
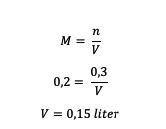
لذا ، فإن حجم المذيب هو 0.15 لتر.
5. إجمالي 18 جرامًا من الجلوكوز (سي6ح12ا6) مع السيد = 180 مذاب في الماء بحيث يصبح الحجم 0.5 لتر. ما هي مولارية المحلول؟
إجابه :

بادئ ذي بدء ، احسب عدد الشامات أولًا
بعد ذلك ، احسب قيمة المولارية.
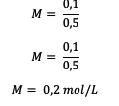
لذا ، فإن مولارية محلول الجلوكوز هي 0.2 مول لكل لتر.
6. لجعل 100 مل من محلول 01 ، M NaOH ، كم جرام من NaOH (Mr = 40) يجب إذابته؟
إجابه :

لذلك ، يأخذ 0.4 جرام من الكتلة المطلوبة من هيدروكسيد الصوديوم.
مشكلة مولالية
1. من المعروف أن كتلة المحلول 11 جرامًا من المذاب ، و 200 جرام من المذيب ، والسيد = 22. إذن ، ما هي المولالية؟
إجابه :
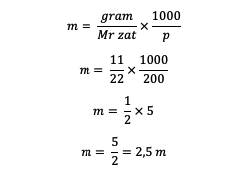
وبالتالي ، يتم الحصول على قيمة مولية 2.5 متر.
2. يضاف ما مجموعه 250 جرامًا من الماء إلى 17.1 جرامًا من محلول قصب السكر الذي يحتوي على السيد = 342. ما هي مولالية الحل؟
إجابه :

إذن ، مولودية المحلول هي 0.2 م.
3. ما هي مولالية محلول مكون من 4 جرامات من هيدروكسيد الصوديوم (إذا كان معروفًا أن Ar Na = 23 ، O = 16 ، H = 1) مذاب في 250 جرامًا من الماء؟
إجابه :
قبل حساب المولية ، مطلوب منا حساب الكتلة النسبية أولاً.
السيد = 23 + 16 + 1 = 40 جرام / مول
بعد ذلك ، لنحسب المولية.
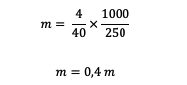
إذن ، المولالية الموجودة في محلول هيدروكسيد الصوديوم هي 0.4 م.
4. ما مولودية محلول HCl 37٪ إذا كان معروفًا أن Ar H = 1 و Ar Cl = 35.5؟
إجابه :
السيد = 1 + 35.5 = 36.5 جرام / مول
كتلة حمض الهيدروكلوريك = 37٪ × 100 جرام = 37 جرام
كتلة المذيب = كتلة المحلول - كتلة حمض الهيدروكلوريك
كتلة المذيب = 100 - 37 جرام
كتلة المذيب = 63 جرام أو 0.063 كيلوجرام
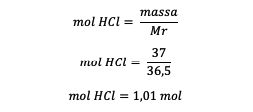
بعد معرفة مولات حمض الهيدروكلوريك ، احسب المولالية
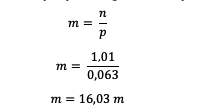
وبالتالي ، يمكن ملاحظة أن مولالي حمض الهيدروكلوريك هو 16.03 مول.
5. ما هي مولالي 15 جرامًا من اليوريا CO (NH.؟2)2 مذاب في 250 جرام من الماء؟ (السيد = 60)
إجابه :
احسب عدد مولات اليوريا أولًا
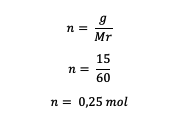
بعد ذلك ، احسب مولالية الحل
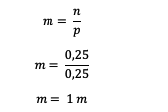
لذا ، فإن مولالي محلول اليوريا هو 1 م.
حسنًا ، هذه معادلة المولارية والمولارية مصحوبة بتعريف وأمثلة للمشكلة. سهل أليس كذلك؟ نأمل من خلال هذه المقالة أن تتمكن من تحسين فهمك ، نعم. روح!
X اغلاق
الإعلانات
الإعلانات
X اغلاق
