إلكترونات التكافؤ: التعريف ، كيفية الحساب ، مثال على المشكلات
جار التحميل...
إلكترونات التكافؤ هي إلكترونات في المستوى الخارجي للذرة يمكنها المشاركة في تفاعلات مع ذرات أخرى. يمكن أن تمثل قيمة التكافؤ ذرة بحيث يمكن رؤية قيمة التفاعل.
يمكن أن يتسبب عدد التكافؤات في الذرة في أن يكون العنصر متفاعلًا أو غير نشط. لهذا السبب ، من المهم جدًا معرفة عدد التكافؤات لتتمكن من معرفة نشاط العنصر ذي الصلة.
قائمة المحتويات
فهم إلكترونات التكافؤ
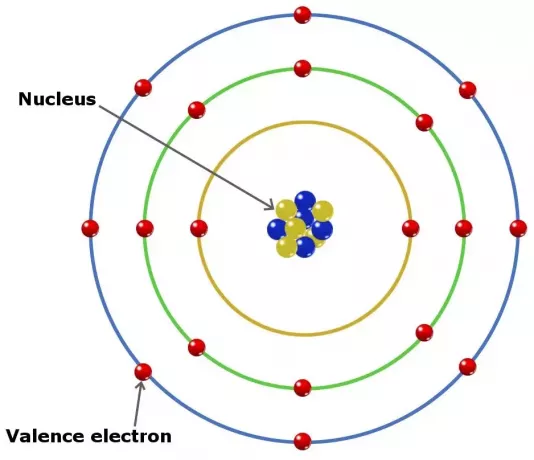
يمكن أن تلعب إلكترونات التكافؤ في الذرات دورًا في تكوين رابطة كيميائية في عنصر ما. في العناصر في المجموعة الرئيسية ، إلكترونات التكافؤ هي الإلكترونات الموجودة في الغلاف الخارجي.
ومع ذلك ، ولكن ليست كل هذه الأنواع من الإلكترونات موجودة في الغلاف الخارجي. في بعض العناصر التي تنتمي إلى المجموعة الانتقالية ، يكون التكافؤ أعمق من الغلاف الخارجي.
اقرأ: التوزيع الإلكترون
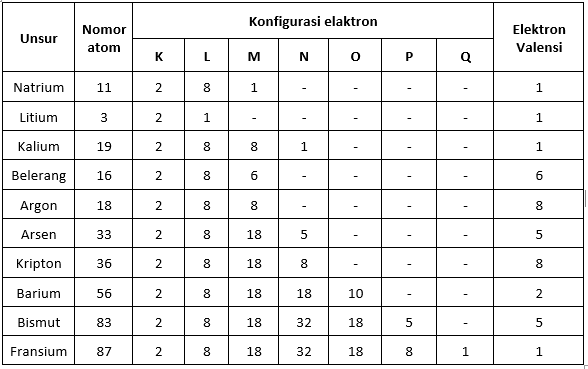
جدول تكافؤ الإلكترون
إلكترونات التكافؤ والنظام الدوري للعناصر
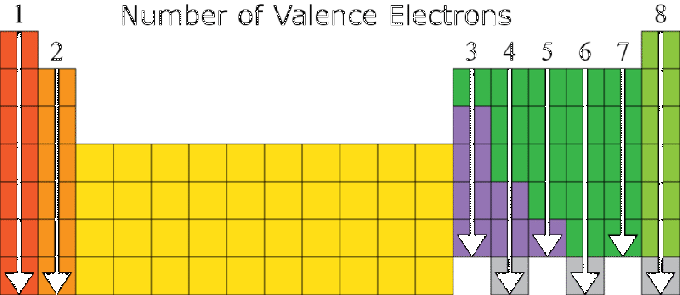
تعتمد خصائص العنصر بشكل كبير على تكوين الإلكترون الخاص به ، خاصةً على رقم التكافؤ الخاص به. العناصر التي لها نفس عدد التكافؤات لها خصائص متشابهة بشكل عام. لهذا السبب ، يتم ترتيب النظام الدوري للعناصر بناءً على زيادة العدد الذري والتشابه في خصائص المادة.
توجد علاقة بين التكوين الإلكتروني لذرة العنصر وموضع العنصر في النظام الدوري ، حيث:
- رقم المجموعة هو نفس عدد قيم التكافؤ ، باستثناء العنصر He في المجموعة VIIIA والمجموعة الانتقالية.
- رقم الفترة يساوي عدد القذائف على الإلكترون.
التوصيل الكهربائي
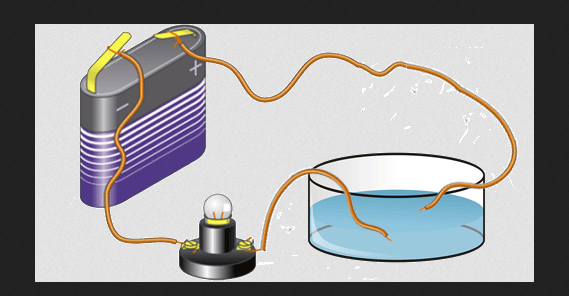
إلكترونات التكافؤ مسؤولة أيضًا عن التوصيل الكهربائي لعنصر ما. هذا ما يجعل العناصر يمكن تصنيفها على أنها غير فلزية وأشباه موصلات ومعادن. تتمتع العناصر المعدنية عمومًا بموصلية كهربائية عالية عندما تكون في الحالة الصلبة.
في كل صف من الجدول الدوري ، يوجد المعدن على يسار اللافلزية. لذا فإن المعادن لها تكافؤات أقل من غير المعادن.
ومع ذلك ، فإن قيمة التكافؤ لذرات المعدن لها طاقة تأين صغيرة وفي الحالة الصلبة ، تكون هذه الإلكترونات حرة نسبيًا لترك ذرة واحدة أو تتحد مع ذرات أخرى.
يمكن تحريك مثل هذه الإلكترونات الحرة بتأثير مجال كهربائي ، ويمكن أن تحتوي حركتها على تيار كهربائي. هذه الإلكترونات مسؤولة عن التوصيل الكهربائي للمعادن. من أمثلة الموصلات الجيدة الألمنيوم والنحاس والذهب والفضة.
تتميز العناصر غير المعدنية بموصلية كهربائية منخفضة ، لذا فهي تعمل كعوازل. يمكن رؤية عناصر مثل هذه في الجدول الدوري على اليمين ولها غلاف تكافؤ نصف ممتلئ على الأقل.
يقال إن طاقة التأين تكون كبيرة إذا لم تتمكن الإلكترونات من مغادرة الذرة بسهولة عند مواجهة مجال كهربائي. لذا فإن هذا النوع من العناصر لديه القدرة على إجراء تيارات صغيرة جدًا.
تشمل أمثلة العناصر العازلة الكبريت والماس. يمكن أيضًا القول أن المركبات الصلبة التي تحتوي على معادن هي عوازل إذا تم استخدام تكافؤ ذرات المعدن لتكوين رابطة أيونية.
اقرأ: ميكانيكا الكم
التوزيع الإلكترون
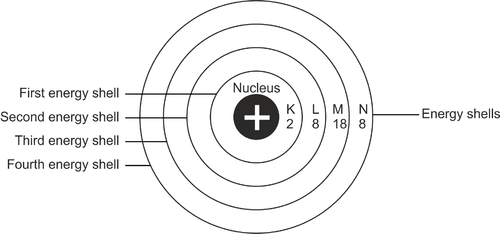
يمكن القول أن عملية التكوين هي ترتيب توزيع الإلكترونات في الذرة. بشكل عام ، ستكون الإلكترونات في مسار معين في الذرة. يتم تحديده بناءً على مستوى طاقة الذرة. هذه المسارات هي قذائف إلكترونية.
يُشار إلى الجزء الأول من طبقة الجلد بالحرف K. ستستمر طبقات الجلد إلى L و M وهكذا بالترتيب الأبجدي. قذيفة K هي الأقرب إلى النواة الذرية. يمكن لكل طبقة من الغلاف أن تستوعب فقط عددًا معينًا من الإلكترونات.
الإعلانات
لذلك إذا كانت ممتلئة ، ستنتقل الإلكترونات إلى الطبقة التالية. يجب ملء جميع طبقات الجلد بأقصى طاقتها.
كيفية حساب إلكترونات التكافؤ

يبدأ موضع الإلكترونات عندما تبدأ في ملء الذرة من الطبقة الأولى من الغلاف. هذه الطبقة من الجلد هي الأقرب إلى النواة الذرية أو يُشار إليها بالحرف K. الطبقة الأولى لديها أدنى مستوى للطاقة. إذا كانت الطبقة الأولى مملوءة بإلكترونين ، فستستمر عن طريق ملء الطبقة التالية المسماة L.
تبلغ سعة الغلاف L 8 إلكترونات. إذا كانت ممتلئة ، فسوف تستمر إلى الطبقة التالية من الجلد تدريجيًا. السعة الكلية للغلاف الخارجي للذرة هي 8 إلكترونات.
العناصر التي تنتمي إلى المجموعة الرئيسية ، يمكن تحديد تكوينها الإلكتروني بناءً على عدد الإلكترونات أو العدد الذري وفقًا للقواعد التالية.
- سيتم شحن الإلكترونات بالكامل إلى الحد الأقصى الذي يمكن أن تستوعبه طبقة الجلد.
- إذا كانت لا تزال هناك إلكترونات متبقية أو لا تستطيع ملء طبقة غلاف الإلكترون إلى أقصى حد ، فعليك الانتباه إلى الأحكام التالية.
- إذا كان عدد الإلكترونات المتبقية> 32 ، فسيتم ملء الجزء التالي من الغلاف بـ 32 إلكترونًا
- إذا كانت الإلكترونات المتبقية أقل من 32 ، فإن طبقة الغلاف التالية سوف تستوعب 18 إلكترونًا ؛
- إذا كانت الإلكترونات المتبقية أقل من 18 ، فسيتم ملء الطبقة التالية بـ 8 إلكترونات.
- إذا كان العدد المتبقي 8 ، يمكن للإلكترونات المتبقية أن تملأ الجزء التالي من الغلاف.
اقرأ: التغيير الجسدي
أمثلة على مشاكل التكافؤ الإلكترون

من أجل فهم المادة بشكل أعمق ، يرجى الاطلاع على بعض الأمثلة والمناقشة التالية.
مثال 1
حدد قيم التكافؤ للعناصر التالية بناءً على تكوينات الإلكترون الخاصة بهم.
- 11نا
- 13ال
- 15ص
- 18أر
- 19ك
إجابه:
- 11Na = 2 8 1
عدد التكافؤات لـ Na = 1
- 13Al = 2 8 3
عدد التكافؤات Al = 3
- 15ف = 2 8 5
إجمالي التكافؤ P = 5
- 18Ar = 2 8 8
عدد التكافؤات Ar = 8
- 19ك = 2 8 8 1
عدد التكافؤات K = 1
مثال 2
قم بإنشاء تكوين إلكتروني وحدد قيم التكافؤ للعناصر التالية باستخدام تكوينات إلكترون الغاز النبيل.
- 20كاليفورنيا
- 35ر
- 36سجل تجاري
- 50Sn
- 86آكانيوز
إجابه:
- 20Ca = 4s2
مجموع قيم التكافؤ لـ Ca = 2
- 35Br = [Ar] 3d10 4 ثانية2 4 ص5
مجموع قيم التكافؤ لـ Br = 7
- 36Kr = [Ar] 3d10 4 ثانية2 4 ص6
مجموع قيم التكافؤ Kr = 8
- 50Sn = [Kr] 4d10 5 ثانية2 5 ص2
مجموع قيم التكافؤ لـ Sn = 4
- 86Rn = [Xe] 4f14 5 د10 6 s2 6 ص6
مجموع قيم التكافؤ Rn = 8
مثال 3
يرجى كتابة إلكترونات العناصر أدناه وتحديد قيم التكافؤ أيضًا.
- 10 ني
- 33 نحن
- 47 اي جي
- 52 تي
- 54 Xe
إجابه:
- 10 ني: 1 ثانية2 2 ثانية2 2 ص6
مجموع قيم التكافؤ ني = 8
- 33 الآس: 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد10 4 ص3
مجموع قيم التكافؤ لـ As = 5
- 47 حج: 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد10 4p6 5s1 4 د10
مجموع قيم التكافؤ لـ Ag = 1
- 52 تي: 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد10 4 ص6 5 ثانية2 4 د10 5 ص4
مجموع قيم التكافؤ لـ Te = 6
- 54 Xe: 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد10 4 ص6 5 ثانية2 4 د10 5 ص6
مجموع قيم التكافؤ لـ Xe = 8
يمكن تحديد إلكترونات التكافؤ بناءً على المسار أو المدار المحدد باستخدام تكوين الإلكترون. على الرغم من أنها تبدو معقدة للغاية ، فإن إتقان هذه المادة هو شيء يجب القيام به حتى تتمكن من حل الأسئلة بسهولة.
X اغلاق
الإعلانات
الإعلانات
X اغلاق
