تكوين الإلكترون: التعريف ، الجداول ، الأمثلة
جار التحميل...
يعلم الجميع أن الذرات هي أصغر مادة لا يمكن تقسيمها كيميائيًا. لكن المادة الأصغر تتكون من عدة جسيمات ، بما في ذلك الإلكترونات. يلعب تكوين الإلكترون دورًا مهمًا في الأنظمة الذرية.
الإلكترونات هي الجسيمات التي تتكون منها الذرات التي لها شحنة سالبة. جنبا إلى جنب مع البروتونات موجبة الشحنة ، والنيوترونات المحايدة ، تشكل هذه الثلاثة مكونات الذرة. توجد الإلكترونات في الغلاف الخارجي للذرة ، بينما توجد البروتونات والنيوترونات في نواة الذرة.
قائمة المحتويات
ما هو تكوين الإلكترون؟
لا يمكن التنبؤ بوجود إلكترون في المدار الذري أو الغلاف إلا إذا تم اتخاذ إجراء قياس لتسهيل اكتشاف موضع الإلكترون. تتحرك الإلكترونات حول نواة الذرة وتبقى في مدار معين. في الواقع ، المدار هو مصطلح آخر للقذيفة الذرية.
تتمتع قذائف الذرات والأجزاء الفرعية بمستويات طاقة مختلفة. يشير تكوين الإلكترون إلى ترتيب الإلكترونات في جزيء أو ذرة أو أي نوع آخر من البنية الفيزيائية. تعتمد الحالة الكمومية للإلكترون على وظيفته الموجية.
دالة الموجة هي دالة للزمان والمكان بقيم معقدة. الإلكترونات قادرة على الانتقال من مستوى طاقة إلى آخر عن طريق الامتصاص الكمي في شكل فوتونات. يوجد في ترتيب الإلكترونات طبقات من المدارات بخصائص مختلفة.
اقرأ: تغيير الفيزياء
1. نوع الجلد الإلكتروني
تنقسم غلاف الإلكترون إلى عدة طبقات متباعدة على مسافات مختلفة. القشرة في الطبقة الأولى الأقرب إلى مركز أو نواة الذرة هي قذيفة K. الطبقة الثانية بعد قذيفة K تسمى قذيفة L. يمثل الغلاف M طبقة الجلد الثالثة ، وهكذا.
يشير الترتيب الأبجدي الذي يمثل نوع غلاف الإلكترون إلى أن الغلاف يتحرك بعيدًا عن النواة الذرية. لتسهيل الفهم ، يمكن أن يمثل الرقم الكمي الرئيسي (n) غلاف الإلكترون.
بمعنى آخر ، الرقم الكمي هو رقم يصف موضع الإلكترونات في الذرة. يشير هذا الرقم إلى طبيعة الإلكترونات في مداراتها ويمثل كمية محفوظة في نظام ديناميكي.
تبدأ الأعداد الكمية التي تمثل الأصداف الذرية بالرقم 1. هذا يعني أن الرقم 1 يمثل الغلاف K ، والرقم 2 يمثل الغلاف L ، والرقم 3 يمثل الغلاف M ، وهكذا.
2. مستويات الطاقة في أغلفة الإلكترون
يُظهر موضع الإلكترونات في مداراتها أو أصدافها كمية مختلفة من الطاقة. لذلك ، يرتبط موقع غلاف الإلكترون ارتباطًا وثيقًا بمستوى طاقة الإلكترونات في مدار الغلاف. باختصار ، تحدد مسافة غلاف الإلكترون من مركز الذرة طاقة الإلكترون.
كلما زاد الرقم n ، زادت مسافة غلاف الإلكترون عن المركز الذري وزادت طاقة الإلكترون في الغلاف المقابل. عادة تملأ الإلكترونات المدارات على الذرات في الغلاف K أولاً والتي تحتوي على أقل مستويات الطاقة.
3. عدد الإلكترونات في كل غلاف
بشكل أساسي ، عدد الإلكترونات التي تملأ أغلفة الإلكترون له حد معين. الحد الأقصى لعدد الإلكترونات في الغلاف الخارجي للذرة هو 8. لتحديد عدد الإلكترونات التي تسكن غلافًا معينًا ، يمكنك استخدام الصيغة التالية:
غلاف الإلكترون n = 2n²
اقرأ: لحظة من الجمود
جدول تكوين الإلكترون
تمت كتابة ترتيب الإلكترونات في عنصر ما وفقًا للقواعد التي يتفق عليها العلماء. يعد مفهوم تكوين أو ترتيب إلكترونات الذرات أمرًا بالغ الأهمية في فهم البنية في الجدول الدوري للعناصر. جدول التكوين أو ترتيب الإلكترونات وعناصرها مذكور أدناه.

مثال على مشكلة تكوين الإلكترون
غالبًا ما تطرح موضوعات الكيمياء أسئلة تتعلق بترتيب الإلكترونات. إنها لفكرة جيدة أن تتدرب على الإجابة عن أسئلة حول تكوين أو ترتيب الإلكترونات مثل ما يلي.
ما هو تكوين وعدد الإلكترونات في كل غلاف إلكترون في ذرات العنصرين Sr (Z = 38) و Ni (Z = 28)؟
إجابه:
ريال (ع = 38)
1 ثانية² 2 ثانية² 2p⁶ ؛
3 ثوانٍ² ؛ 3p⁶ ؛
4 ثانية² ؛ 3D¹⁰ ؛ 4p⁶ ؛ 5 ثوانٍ²
أو [كر] 5 ث²
ك = 2
L = 8
م = 18
الإعلانات
العدد = 8
س = 2
ني (ع = 28)
1 ثانية² 2 ثانية²
2p⁶ ؛ 3 ثوانٍ² ؛ 3p⁶ ؛
4 ثانية² 3D⁸
أو [Ar] 4s² 3d⁸
ك = 2
L = 8
م = 16
ن = 2
اقرأ: ميكانيكا الكم
كامل / نصف القواعد الكاملة

كل مدار إلكترون أو قشرة فرعية لها حدودها الخاصة للإلكترونات التي تشغلها. يمكن أن يساعد هذا في القواعد الكاملة ونصف الكاملة. بشكل عام ، هناك 4 أنواع من الأجزاء الفرعية ، بما في ذلك s و d و f و p حيث تحتوي كل قشرة فرعية على عدد مختلف من الإلكترونات.
1. قشرة فرعية
يمكن أن يستوعب المدار s الإلكترونات بحد أقصى 2.
2. ص. subshell
الحد الأقصى لعدد الإلكترونات في الجزء الفرعي p هو 6.
3. د قشرة فرعية
الحد الأقصى لعدد الإلكترونات في d هو 10.
4. و. قشرة فرعية
يمكن للقشرة الفرعية f استيعاب 14 إلكترونًا كحد أقصى.
يتم كتابة المدارات وعدد الإلكترونات فيها عن طريق تضمين رقم الغلاف أولاً ، ثم المدار ، وأخيراً عدد الإلكترونات.
فمثلا:
1 ثانية² ؛ 2 ثانية² ؛ 2p⁶ ؛
3 ثانية² ؛ 3p⁶ ؛
4 ثانية² ؛ 3d¹⁰ ؛ 4p⁶
إلخ
وهكذا ، فإن القاعدة الكاملة أو الجزئية في ترتيب الإلكترون تُظهر أن الإلكترون قادر على الانتقال من مدار إلى آخر من أجل الحصول على ترتيب أكثر استقرارًا. تنطبق هذه القاعدة على التكوينات التي تنتهي بقشرة فرعية d.
اقرأ: الطاقة الكامنة
رسم تخطيطي مداري
يتبع موقع الإلكترونات في الطبقات القليلة الأولى من الغلاف إلى الأبعد عن الذرة ميكانيكا الكم. يشير مصطلح الرسم البياني المداري إلى وصف الإلكترونات في المدارات الذرية.
في هذا الرسم البياني ، يمثل السهم لأعلى أو لأسفل إلكترونًا. بينما المداري ، حيث تكون الإلكترونات على شكل صندوق. المدار s به 1 مربع ، و d 5 مربعات ، و p بها 3 مربعات و f بها 7 مربعات.
عند عمل المخططات المدارية ، من الضروري الانتباه إلى القواعد التي تشمل قاعدة هوند ومبدأ استبعاد باولي. مزيد من الشرح لهذه القواعد أدناه.
اقرأ: أبعاد الطاقة
مبدأ حظر Paulis
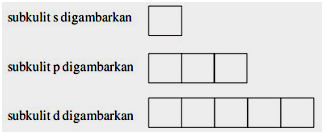
وفقًا لمبدأ استبعاد باولي ، لا يمكن أن يكون هناك أكثر من إلكترونين في مدار ذري. لذلك يمكن للإلكترونات أن تنتقل فقط من مدار إلى آخر إذا كانت تحتوي على الفراغ. على سبيل المثال ، تظهر ذرة بها إلكترونان في مدار 1s في الشكل أدناه:
قواعد هوند
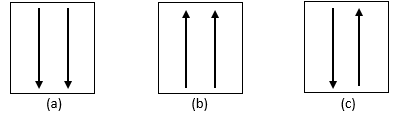
تنص قاعدة Hund على أن المدارات التي لها نفس الطاقة يتم ملؤها أولاً بإلكترون واحد له نفس الطاقة لها نفس الاتجاه أو الدوران ، ثم تدخل الإلكترونات المدارات بالتتابع في الاتجاه عكس.
أي ، في نفس الغلاف الفرعي ، يحتوي كل مدار على إلكترون واحد مع نفس السهم في الاتجاه ، ثم يتم ملء الإلكترونات المتبقية بواسطة زوج من الإلكترونات في الاتجاه المعاكس للسهم. مزيد من الشرح في الصورة التالية.

الإلكترونات في ترتيب معين في الذرة. المصطلح الذي يصف هذا الترتيب هو تكوين الإلكترون. من خلال فهم جداول التكوين والمخططات المدارية والقواعد الأخرى ، يمكن الإجابة بسهولة على مسألة تكوين أو ترتيب الإلكترونات.
X اغلاق
الإعلانات
الإعلانات
X اغلاق
