معدل التفاعل: التعريف ، الصيغ ، العوامل ، أمثلة المشاكل
إذا سبق لك أن رأيت مكواة كانت طبيعية في البداية ولكنها أصبحت صدئة أو لاحظت تغيرًا في اللون في المحلول المختلط ، ترى بدون وعي مفهومًا كيميائيًا يسمى "المعدل". تفاعل".
العلم المتعلق بمعدل التفاعل مفيد للغاية في العالم الصناعي ، لأن الأنشطة الصناعية تستخدم التفاعلات الكيميائية في عملية الإنتاج.
إن متغيرات الوقت والجهد والتكلفة الموجودة في الصناعة هي أيضًا ذات مغزى كبير ، وبالتالي فإن مفهوم فيما يتعلق بمعدل رد فعل سريع وخاضع للرقابة سيكون مفيدًا جدًا للاعبين في الصناعة الذي - التي.
جدول المحتويات
فهم معدل رد الفعل

معدل التفاعل هو تغير في تركيز المواد المتفاعلة والنواتج لكل وحدة زمنية.
للتفاعل مع المواد المتفاعلة A و B سينتج المنتجان C و D كما في معادلة التفاعل أدناه ، بمرور الوقت سينخفض عدد الجزيئات المتفاعلة A و B ويزداد عدد جزيئات المنتج C و D ، ثم صيغة معدل التفاعل (v) يصبح:

من المفترض أن تكون العلامة السلبية في معدل التغير في تركيز المواد المتفاعلة A و B (المتفاعلات) موجبة ، حيث أن معدل التفاعل هو كمية يجب أن تكون قيمتها موجبة دائمًا.
وحدتها M s-1 أو الشامات L-1 s-1.
لكن هناك معادلة أخرى لمعدل التفاعل وهي:
للتفاعلات الكيميائية:
aA + bB → pP + qQ
العلاقة بين معدل التفاعل والمولارية:
ت = ك [A]ن[ب]م
معلومة:
- v = معدل التفاعل
- k = ثابت معدل التفاعل
- م = ترتيب تفاعل المادة أ
- ن = ترتيب التفاعل للمادة ب
لا يمكن تحديد ترتيب التفاعل بين المادة أ والمادة ب إلا تجريبيًا.
نظرية الاصطدام
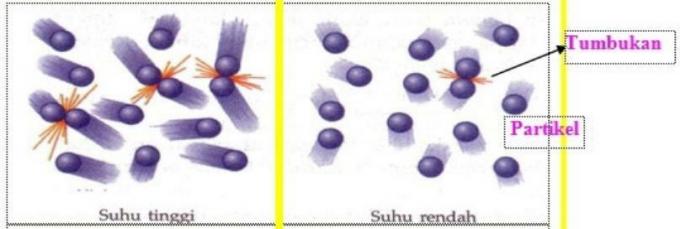
تنص نظرية الاصطدام على أن الجسيمات المتفاعلة يجب أن تتصادم مع بعضها البعض من أجل التفاعل.
تسمى الاصطدامات التي تحدث بين الجسيمات المتفاعلة التي تنجح في إنتاج تفاعل التصادمات الفعالة.
الحد الأدنى من الطاقة التي يجب أن تكون موجودة في الجسيمات المتفاعلة من أجل تصادم فعال يسمى طاقة التنشيط (Ea).
بشكل عام ، يعتمد معدل التفاعل على عدة أشياء مثل:
1. اتجاه (اتجاه) تصادم الجسيمات
في تفاعل نموذجي ، يجب أن تكون الجسيمات في اتجاه معين في وقت الاصطدام حتى يؤدي التصادم الفعال إلى تفاعل.
على سبيل المثال في التصادم الذي يحدث بين جزيئات غاز NO مع جزيئات غاز NO3 في التفاعل:
NO (g) + NO3 (g) → 2NO2 (ز)
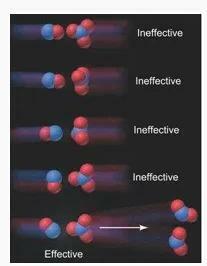
توضيح لأهمية اتجاه الاصطدام (المصدر: Silberberg، Martin S. 2009. الكيمياء: الطبيعة الجزيئية للمادة والتغيير (الطبعة الخامسة). نيويورك: ماكجرو هيل)
2. التردد الذي تصطدم به الجسيمات
كلما زاد تواتر تصادم الجسيمات (تردد التصادم العالي) ، زادت فرصة حدوث تصادمات فعالة مما يجعل معدل التفاعل أسرع.
3. طاقة الجسيمات المتفاعلة المتصادمة
يجب أن تتجاوز طاقة الجسيمات المتفاعلة المتصادمة طاقة التنشيط ، وهي حاجز الطاقة لحدوث التفاعل ، بحيث يمكن أن يحدث التفاعل. كلما انخفضت طاقة النشاط ، كان معدل التفاعل أسرع.
قانون معدل التفاعل
في معدل التفاعل ، بشكل عام ، يتم التعبير عن الوحدة على أنها مولات / لتر (اقرأ: مول لكل لتر) أو ما يعرف أيضًا باسم المولارية.
المولارية مقياس لعدد مولات المذاب في لتر واحد من المحلول.
هناك قانون معدل التفاعل.
قانون معدل التفاعل هو معادلة توضح العلاقة أو العلاقة بين معدل تفاعل معين وتركيز المواد المتفاعلة.
هنا هو قانون معدل التفاعل:
ص = ك [X]أ[Y]ب[Z]ج
معلومة:
- ك = معدل ثابت
- [X] ، [Y] ، [Z] = تركيز المادة المتفاعلة
- أ ، ب ، ج = ترتيب التفاعل
إذا انتبهت إلى الصيغة أعلاه ، فبالإضافة إلى تحديد معدل التفاعل ، هناك أيضًا ترتيب التفاعل.
ترتيب التفاعل هو قوة المولارية في معادلة معدل التفاعل ، أو بشكل أكثر بساطة أن ترتيب التفاعل هو معدل تفاعل مادة ما.
سيظهر ترتيب التفاعل العلاقة بين التغيرات في التركيز والتغيرات في معدل التفاعل.
نحن سوف، يتم التعبير عن العلاقة بين الاثنين باستخدام الرسم البياني لأمر رد الفعل.
هناك ثلاثة رسوم بيانية لأمر رد الفعل ، لمزيد من المعلومات ، انظر المراجعة أدناه.
ترتيب رد الفعل ومعدل رد الفعل ثابت
1. ترتيب رد الفعل
لم يتم تحديد ترتيب التفاعل من معامل التفاعل ، ولكن من البيانات التجريبية. يمكن أن تكون قيمة أمر التفاعل كسرًا أو رقمًا موجبًا أو صفرًا أو سالبًا.
رياضياً ، قيمة ترتيب التفاعل الكلي هي مجموع أوامر التفاعل الإجمالية للمواد المتفاعلة.
مثال:

فيما يلي ثلاثة أوامر تفاعل إجمالية كاملة مع الرسوم البيانية ، بما في ذلك:
أ. ترتيب رد الفعل الكلي الصفري
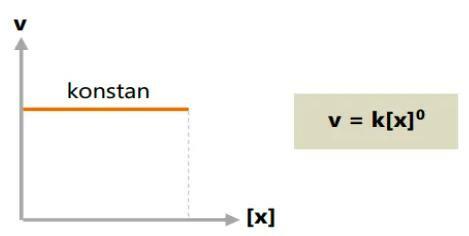
في التفاعل الصفري ، لن يتأثر معدل التفاعل بتركيز المادة (ثابت).
ب. ترتيب رد الفعل الكلي واحد
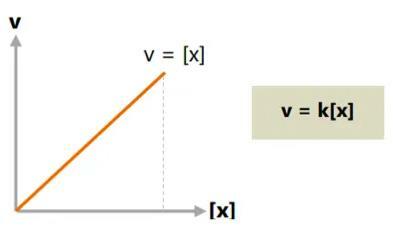
في تفاعل من الدرجة الأولى ، تكون الزيادة في معدل التفاعل مساوية أو تتناسب طرديًا مع التغير في تركيز المادة.
إذا تضاعف التركيز ، سيكون معدل التفاعل أسرع مرتين من ذي قبل. وبالمثل هكذا.
ج. ترتيب رد الفعل الكلي الثاني
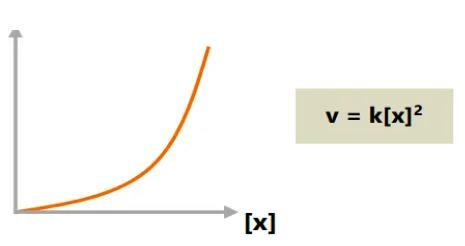
يمكن أن تكون الزيادة في معدل التفاعل متناسبة ، طالما أن الزيادة في تركيز المواد المتفاعلة مربعة.
على سبيل المثال ، إذا تضاعف تركيز المادة المتفاعلة ، فسيتم مضاعفة معدل التفاعل أربع مرات.
ملحوظة: لا يمكن تحديد ترتيب التفاعل من شكل معادلة التفاعل. لا يمكن تحديد ترتيب التفاعل إلا من النتائج التجريبية عن طريق تغيير متغير الضغط (خاصة للتفاعلات الغازية) أو مولاريته (التفاعلات مع المحاليل والغازات).
2. معدل رد الفعل ثابت
ثابت معدل التفاعل (k) هو ثابت تعتمد قيمته على نوع المادة المتفاعلة ودرجة الحرارة والمحفز.
معدل ثابت لرد الفعل هذا يتناسب عكسيا مع تغير الوقت. كلما حدث التفاعل بشكل أسرع ، زادت قيمة k.
وفي الوقت نفسه ، قيمة معدل التفاعل ثابتة يتناسب طرديا مع تغيرات درجة الحرارة. كلما ارتفعت درجة حرارة التفاعل ، زادت قيمة k.
العوامل المؤثرة في معدل التفاعل
يمكن أن يتأثر معدل التفاعل بعدة عوامل ، يتم شرحها باستخدام النظرية والتجريب ، إلى جانب مزيد من المعلومات.
1. تجريبيا

من الناحية التجريبية ، هناك عدة عوامل يمكن أن تؤثر على معدل التفاعل ، بما في ذلك:
أ. المتغير المستقل أو التلاعب
هو متغير يمكن تغييره في التجربة.
مثال:
- حجم رقاقة الرخام (عامل مساحة السطح).
- تركيز المادة (عامل التركيز).
ب. متغير متحكم فيه
إنه متغير يظل ثابتًا طوال التجربة.
مثال:
- حل يغير تركيزه ، على الرغم من تغير التركيز ، يبقى نوع المحلول كما هو.
ج. متغير تابع / استجابة
هو متغير ناتج عن الأنشطة التجريبية.
مثال:
- من جميع التجارب على العوامل التي يمكن أن تؤثر على معدل التفاعل ، البيانات الناتجة في شكل معدلات التفاعل ووقت التفاعل (الوقت).
2. نظريا

فيما يلي بعض العوامل التي يمكن أن تؤثر على معدل التفاعل نظريًا ، من بين أمور أخرى:
أ. المس منطقة السطح
تلعب مساحة سطح اللمس دورًا مهمًا للغاية ، مما قد يؤدي إلى زيادة معدل التفاعل.
وبالمثل ، إذا كانت مساحة سطح منطقة التلامس أصغر ، كلما كانت الاصطدامات بين الجزيئات أصغر ، وبالتالي سيكون معدل التفاعل أيضًا أصغر.
خصائص الجسيمات التي تتفاعل لها تأثير أيضًا. كلما كانت الرقاقة أدق ، زادت سرعة الاستجابة. بينما تكون الرقاقة خشنة ، تستغرق وقتًا أطول لتتفاعل.
ب. تركيز
نظرًا لأن معادلة معدل التفاعل يتم تعريفها على أنها تركيز المواد المتفاعلة ، فكلما زاد التركيز ، يزداد معدل التفاعل أيضًا.
هذا يعني أنه كلما زاد التركيز ، زادت الجزيئات المتفاعلة.
بهذه الطريقة ، ستزداد أيضًا احتمالية الاصطدامات مما يؤدي إلى زيادة سرعة التفاعل.
لذلك كلما زاد التركيز ، كان معدل التفاعل أسرع.
ج. درجة حرارة
تلعب درجة الحرارة أيضًا دورًا في التأثير على معدل التفاعل.
إذا زادت درجة حرارة التفاعل الذي يحدث ، فسوف يتسبب ذلك في تكوّن الجسيمات كلما كانت الحركة أكثر نشاطًا ، ستحدث التصادمات كثيرًا ، مما يؤدي إلى زيادة معدل التفاعل كبير.
من ناحية أخرى ، إذا تم خفض درجة الحرارة ، ستكون الجسيمات أقل نشاطًا ، وبالتالي سيكون معدل التفاعل أصغر.
درجة الحرارة هي خاصية فيزيائية للمادة التي تعبر عن الفكرة العامة للحرارة والبرودة كمياً.
د. مولارية
المولارية هي عدد مولات المذاب المذاب لكل وحدة حجم للمذيب.
العلاقة مع معدل التفاعل هي أنه كلما زادت مولارية مادة ما ، كلما كان التفاعل أسرع.
وهكذا ، عند المولارية المنخفضة ، سيستمر التفاعل ببطء أكثر من المولارية العالية.
ه. عامل حفاز
المحفز هو مادة يمكنها تسريع معدل التفاعل الكيميائي عند درجة حرارة معينة ، دون أن يتغير بواسطة التفاعل نفسه.
المحفز له دور في التفاعل ولكن ليس كمتفاعل أو منتج. تسمح المحفزات بحدوث التفاعلات بشكل أسرع / تسمح بالتفاعلات عند درجات حرارة منخفضة بسبب التغيرات التي تحدثها في المواد المتفاعلة.
يوفر هذا المحفز مسارًا مفضلاً مع طاقة تنشيط أقل. يمكن أن تقلل المحفزات الطاقة اللازمة لحدوث التفاعل.
هناك مجموعتان من المحفزات ، بما في ذلك:
- محفز غير متجانس
إنه محفز في مرحلة مختلفة عن المواد المتفاعلة في التفاعل الذي يحفزه.
مثال على محفز غير متجانس: يوفر هذا المحفز سطحًا تتشابك فيه المواد المتفاعلة (أو الركيزة) مؤقتًا. ستكون الروابط على الركائز ضعيفة بما يكفي للسماح بتكوين منتجات جديدة. تكون الرابطة بين المنتج والمحفز أضعف ، لذلك يتم تحريرها في النهاية. - محفز متجانس
يتفاعل عادةً مع واحد أو أكثر من الكواشف من أجل تكوين وسيط كيميائي يتفاعل بعد ذلك لتشكيل المنتج النهائي للتفاعل ، في عملية تستعيد المحفز.
ما يلي هو مخطط عام للتفاعل الحفزي ، حيث يمثل C المحفز:
A + C → AC... (1)
B + AC → AB + C... (2)
على الرغم من أن المحفز (C) يتم استهلاكه من خلال التفاعل 1 ، فإنه يتم تجديده بعد ذلك عن طريق التفاعل 2 ، بحيث يصبح التفاعل الكلي:
أ + ب + ج ← أب + ج
تتضمن بعض المحفزات التي تم تطويرها محفز Ziegler-Natta الذي يستخدم في الإنتاج الضخم للبولي إيثيلين والبولي بروبيلين.
أفضل تفاعل تحفيزي معروف هو عملية هابر ، وهي تخليق الأمونيا باستخدام الحديد العادي كمحفز.
المحول الحفاز الذي يمكنه تدمير منتجات انبعاث المركبات الصعبة للغاية ، مصنوع من البلاتين والروديوم.
مثال على المشاكل
لتسهيل فهم ما ورد أعلاه ، إليك بعض الأمثلة على الأسئلة التي يمكنك دراستها ، بما في ذلك:
1. ضع في اعتبارك البيانات الموجودة في الجدول التجريبي لتكوين غاز H2 أدناه.
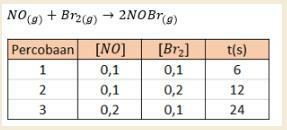
ح. تجربة تفاعل تكوين الغاز
حدد ترتيب التفاعل ، وثابت المعدل للتفاعل ، وكذلك معدل التفاعل!
إجابه:
أ. حدد ترتيب التفاعل لأول أكسيد النيتروجين (NO)!
من أجل تحديد ترتيب تفاعل NO ، يجب تحديده عندما يكون تركيز Br2 هو نفسه ، أي في التجارب 1 و 3 عندما يكون تركيز البروم 0.1 م.
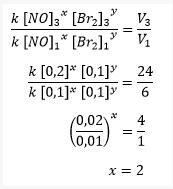
حساب ترتيب تفاعل أول أكسيد الصوديوم
ب. تحديد ترتيب التفاعل مع البروم (Br2)
للعثور على ترتيب تفاعل البروم (Br2) ، يجب تحديده عندما يكون تركيز أكسيد النيتروجين هو نفسه ، أي في التجارب 1 و 2 عندما يكون تركيز أول أكسيد النيتروجين 0.1 م.
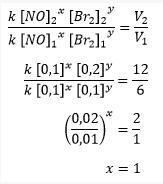
حساب ترتيب تفاعل البروم
ثم يتم الحصول عليها إذا كان ترتيب تفاعل أول أكسيد الصوديوم (NO) هو 2 وترتيب تفاعل البروم (Br2) هو 1.
ج. تحديد ثابت المعدل لتفاعل بروميد النيتروسيل (NOBr2) باستخدام البيانات التجريبية الأولى
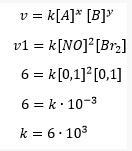
حساب معدل تفاعل بروميد النيتروزيل
بحيث يكون ثابت معادلة المعدل لتكوين بروميد النيتروسيل 6000 ، ثم يمكن حساب معدل التفاعل على النحو التالي:
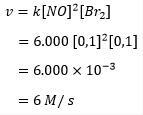
لذلك يمكن ملاحظة أن معدل تفاعل تكوين البروم هو 6 مول في الثانية. مما يعني أنه في التفاعل بين أول أكسيد الصوديوم والبروم ، يمكن أن تشكل كل ثانية ما يصل إلى 6 مواد مولارية من بروميد النيتروسيل.
