الروابط الأيونية: التعريف ، عملية التشكيل ، التفرد ، الأمثلة
الروابط الكيميائية هي روابط يمكن أن تحدث بسبب وجود عناصر مختلفة في ظروف غير مستقرة ولكن تحاول أن تصبح مستقرة مثل الغازات روابط نبيلة من خلال تكوين روابط مع عناصر أخرى ، وانطلاقا من نوع الرابطة ، تنقسم الروابط الكيميائية إلى 2 ، وهما الروابط التساهمية والروابط الكيميائية. أيون.
جدول المحتويات
تعريف الرابطة الأيونية
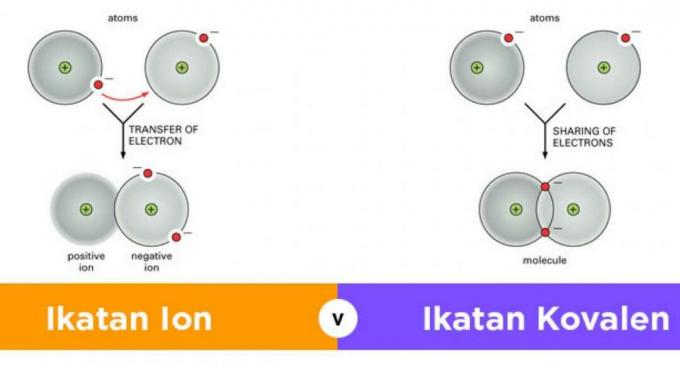
الروابط الأيونية أو الروابط الأيونية هي روابط يمكن أن تحدث نتيجة لانتقال الإلكترونات من ذرة إلى أخرى.
هناك عدة شروط لتكوين الرابطة الأيونية ، بما في ذلك:
- نقل الإلكترونات من عنصر إيجابي كهربائي إلى عنصر كهرسلبي.
- مكون بين العناصر التي تكون موجبة للكهرباء (معادن) مع عناصر كهرسلبية (غير فلزية).
- ستفقد العناصر الكهربية الإلكترونات لتكوين الكاتيونات ، بينما تكتسب العناصر الكهربية إلكترونات لتكوين الأنيونات.
ليس هذا فقط ، يمكن أن تحدث هذه الرابطة الأيونية أيضًا بسبب تسليم الإلكترونات ، مما ينتج عنه أيونات موجبة وأيونات سالبة تكون تكويناتها الإلكترونية مماثلة لتلك الموجودة في الغازات النبيلة.
ترتبط الأيونات الموجبة والأيونات السالبة معًا بقوة إلكتروستاتيكية. يشار إلى المركب الناتج على أنه مركب أيوني.
عملية تكوين الرابطة الأيونية
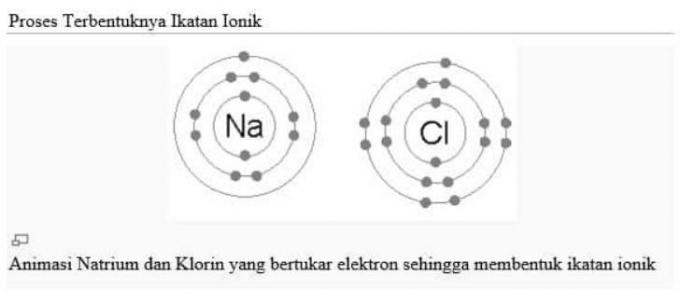
يجب أن يسعى كل عنصر إلى الحصول على تكوين إلكتروني مثل الغاز النبيل ، إما عن طريق التخلي عن الإلكترونات أو قبول استقرار الإلكترونات.
يمكن أن يتم حدث تسليم الإلكترون هذا مع مركبات NaCl المعروفة أيضًا باسم ملح الطعام.
وصف:
Na هي مجموعة IA حيث يحتوي IA على إلكترون تكافؤ واحد ، لذلك لكي يكون مستقرًا ، يجب أن يكون IA قادرًا على فقد إلكترون واحد.
عندما ينظر إليها من تكوين الإلكترون ، ثم 11Na: 2 ، 8 ، 1.
لذلك عندما يتم إطلاق إلكترون واحد ، سيكون آخر إلكترون 8 (وفقًا لقاعدة الثمانيات).
لأن إزالة إلكترون واحد ، فإن Na الذي كان محايدًا في الأصل سيتحول إلى شحنة +1 (Na +).
رد فعله:
Na → Na + + e- (مما يعني أن Na تفقد إلكترونًا واحدًا ، انظر الإلكترون على يسار السهم).
إذن أين يتم إطلاق حوالي 1 إلكترون بواسطة Na؟
يتم التقاط الإلكترونات المحررة بواسطة Cl. لأن Cl لديه 7 إلكترونات تكافؤ (تنتمي إلى المجموعة VIIA).
لذلك عند النظر إليها من تكوين الإلكترون 17Cl: 2 ، 8 ، 7. لذلك إذا كان Cl يلتقط إلكترونًا واحدًا ، فسيتغير تكوينه إلى 2 ، 8 ، 8 ، مع كون الإلكترون الأخير هو 8 ، فهذا يطيع قاعدة الثمانيات.
نظرًا لأن Cl قد استحوذ على إلكترون واحد ، فإن Cl الذي كان محايدًا في الأصل سيتغير إلى -1 (Cl-).
رد فعله:
Cl + e- → Cl- (مما يعني أن Cl يقبل إلكترونًا واحدًا ، انظر الإلكترون الموجود على يسار السهم).
تأثير تكوين Na + و Cl- وفقًا لقانون كولوم ، ستجذب الشحنات من أنواع مختلفة بعضها البعض.
لذلك فإن Na + هذا سوف يرتبط بـ Cl- في وجود القوة الكهروستاتيكية.
Na + + Cl- → NaCl
لمزيد من التفاصيل انظر الصورة أدناه:
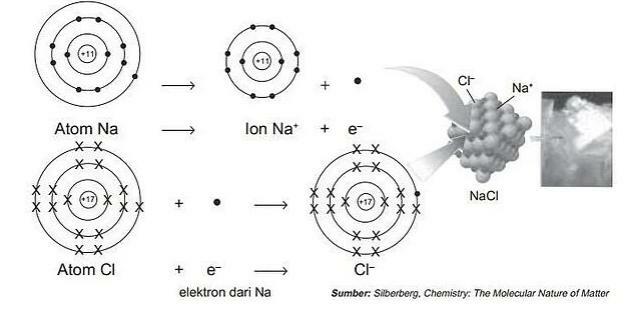
عملية تكوين الروابط الأيونية مع كلوريد الصوديوم.
ثم يمكن ملاحظة أن العناصر المكونة هي:
الرابطة الأيونية = معدن + غير معدني
إذا تم تعميم هذه الروابط المعدنية ، فإنها تشمل:
- المجموعة IA (باستثناء H).
- IIA (باستثناء Be).
- IIIA (ألمنيوم).
- المجموعة الانتقالية (المجموعة ب).
أما بالنسبة للغير المعدنية ومنها:
- مجموعات IVA-VIIA.
- إذا كانت VIIIA مستقرة نسبيًا.
مثال:
- يحتوي K2O على رابطة أيونية ، لأن K ينتمي إلى المعدن (المجموعة IA) وينتمي O إلى المجموعة غير المعدنية (المجموعة VIA).
- لا يحتوي CH4 على رابطة أيونية ، لأن C مدرج في المجموعة غير المعدنية (المجموعة IVA) و H أيضًا غير معدنية (المجموعة IA ، ولكن بالنسبة لـ H فهي تساهمية).
- KF له رابطة أيونية ، لأن K ينتمي إلى المجموعة المعدنية (المجموعة IA) و F ينتمي إلى المجموعة غير المعدنية (المجموعة VIIA).
تفرد الروابط الأيونية

فيما يلي بعض الميزات الفريدة للروابط الأيونية ، بما في ذلك:
- من السهل جدًا توصيل المركبات الأيونية بالكهرباء عندما تكون في المحلول.
- يتم إنشاء الروابط الأيونية أو تشكيلها بين أيونات معدنية (أيونات موجبة) وأيونات غير معدنية (أيونات سالبة).
- الروابط الأيونية قابلة للذوبان بسهولة في الماء والمذيبات القطبية الأخرى.
- تميل المركبات الأيونية إلى تكوين مواد صلبة بلورية ذات نقاط انصهار عالية جدًا.
- تبدأ تسمية الروابط الأيونية البسيطة باسم المعدن ، متبوعًا باسم غير المعدني الذي يتكون منه. مثال: كلوريد الصوديوم.
تحدث الروابط الأيونية بسبب القوة الجاذبة بين الأيونات الموجبة الشحنة والأيونات السالبة الشحنة.
أمثلة على الروابط الأيونية
أحد الأمثلة على الرابطة الأيونية التي غالبًا ما يتم مواجهتها في الحياة اليومية هو ملح الطعام.
يوجد في ملح الطعام صيغة كيميائية وهي NaCl (كلوريد الصوديوم).
في كلوريد الصوديوم الصلب توجد رابطة بين أيونات الصوديوم والكلوريد بواسطة القوة الكهروستاتيكية ، لذلك يمكن تسميتها رابطة أيونية.
الشكل البلوري لـ NaCl عبارة عن سلسلة من أيونات Na + مع كلونات. أيون Na + واحد محاط بستة كلونات وكليون واحد محاط بستة أيونات Na + كما هو موضح في الشكل أدناه.
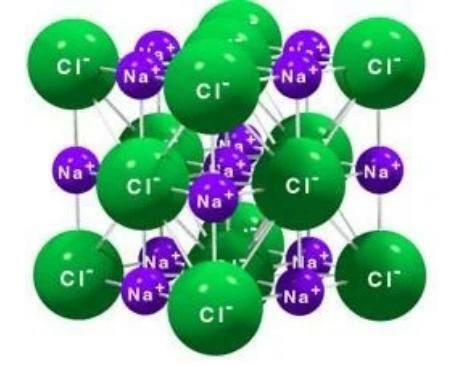
الشكل هيكل كلوريد الصوديوم (1 كلوريد محاط بـ 6 Na والعكس 1 Na محاط بـ 6 Cl).
