الأحماض والأسس: التعريف ، النظرية ، الخصائص ، التصنيف ، أمثلة المشاكل
الأحماض والقواعد مركبان كيميائيان لهما أدوار مهمة للغاية في الحياة اليومية.
بشكل عام ، تحتوي المواد المختلفة ذات المذاق الحامض على حمض ، على سبيل المثال حمض الخليك في خل الطعام ، وحمض الستريك في البرتقال ، وحمض البنزويك المستخدم كمواد حافظة غذاء.
نحن سوف، هذه المرة سنناقش بمزيد من التفاصيل المتعلقة بالقاعدة الحمضية ، اقرأ المراجعات التالية بعناية ، نعم.
جدول المحتويات
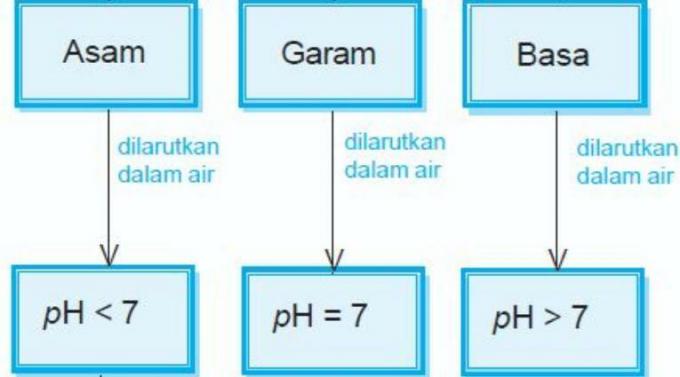
تعريف حمض القاعدة
1. حامض
في دروس الكيمياء ، الأحماض عبارة عن مركبات كيميائية تنتج محلولًا بدرجة حموضة أقل من 7 عند إذابتها في الماء.
وفي الوقت نفسه ، بالمعنى الحديث ، فإن الحمض هو مادة يمكنها التبرع بالبروتون (H + ion) إلى مادة أخرى (تسمى القاعدة) ، أو يمكن أن تقبل زوجًا منفردًا من الإلكترونات من القاعدة.
لذلك يمكن ملاحظة أن الحمض مادة (مركب) تسبب طعمًا حامضًا في مواد مختلفة.
أمثلة على الأحماض: الجير والطماطم والليمون.
خصائص الحمض:
- قد يسبب تآكل.
- الطعم حامض.
- فتاه <7.
- يمكن أن تنتج أيونات H +.
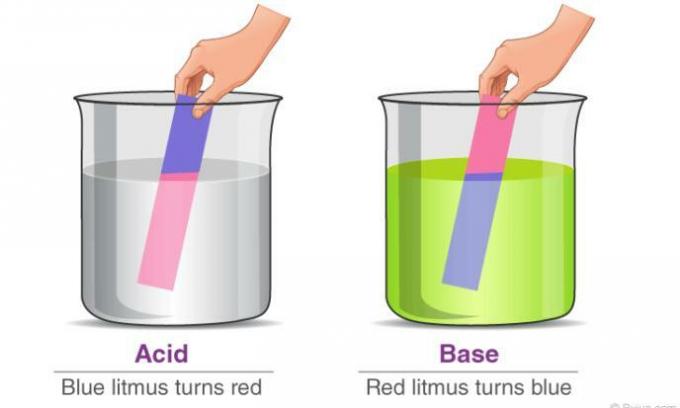
- يحول ورق عباد الشمس الأزرق إلى اللون الأحمر.
نوع محلول الحمض:
- حامض قوي.
- حمض أستريك.
2. لغة
القواعد عبارة عن مركبات كيميائية يمكنها امتصاص أيونات الهيدرونيوم عند إذابتها في الماء. تحتوي هذه القاعدة على درجة حموضة أكبر من 7.
ينص تعريف آخر على أن القاعدة هي مادة (مركب) يمكن أن تتفاعل مع حمض ، منتجة مركبًا يسمى ملحًا.
أمثلة على القواعد: صابون الاستحمام ، الشامبو ، صابون الغسيل ، الأسمدة ، معجون الأسنان ، دواء القرحة.
السمات المميزة:
- له طعم مر.
- يشعر بأنه زلق على الجلد.
- يحول ورق عباد الشمس الأحمر إلى اللون الأزرق.
- ينتج OH- في الماء.
نوع المحلول القلوي:
- لغة فظة.
- لغة ضعيفة.
بشكل عام ، الأحماض أو القواعد أكالة وسامة. خاصة في شكل حلول ذات مستويات عالية. وبالتالي ، فهو شديد الخطورة عند اختباره على طبيعته من خلال طريقة الشعور به.
3. ملح
الملح أو اسم مركبها الكيميائي "كلوريد الصوديوم" (Nacl) في دروس الكيمياء هو مركب أيوني يتكون من أيونات موجبة (كاتيونات) وأيونات سالبة (أنيونات) ، مما ينتج عنه مركبات محايدة (لا محمل).
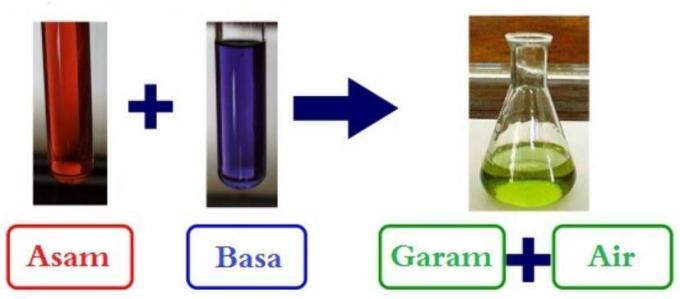
ينتج عن تفاعل الأحماض والقواعد أملاح من أنواع مختلفة. ملح الطعام هو مثال على محلول الملح.
الصيغة: حمض + قاعدة ~ ملح + ماء
نظرية القاعدة الحمضية
من بين النظريات المختلفة المتعلقة بتعريف القاعدة الحمضية التي تم اقتراحها ، هناك ثلاث نظريات تحتاج إلى معرفتها ، بما في ذلك:
1. نظرية قاعدة حمض برونستيد - لوري

في عام 1923 ، كتب يوهانس ن. برونستد مع توماس م. اقترح لوري بشكل منفصل تعريفًا أكثر شمولاً للأحماض والقواعد.
يُنظر إلى المفهوم الذي تم اقتراحه من حقيقة أن تفاعل القاعدة الحمضية يتضمن نقل البروتونات (H + أيونات) من مادة إلى أخرى.
تتضمن عملية نقل البروتون دائمًا حامضًا كمانح أو متبرع بالبروتون وقاعدة كمستقبل للبروتون.
لذلك ، من حيث القاعدة الحمضية وفقًا لـ Brønsted-Lowry ، وهي:
- الأحماض مانحة للبروتون.
- القواعد هي متقبلات للبروتون.
عند النظر إليها في هذه النظرية ، في تفاعل تأين حمض الهيدروكلوريك عند إذابته في الماء ، يعمل حمض الهيدروكلوريك كحمض و H2يا كقاعدة.
حمض الهيدروكلوريك (عبد القدير) + ح2O (ل) → Cl−(عبد القدير) + ح3ا+(أنا)
سيتحول حمض الهيدروكلوريك إلى أيونات Cl− بعد التبرع بنجاح ببروتون (H+) ضد H2س. ح2ثم يقبل O بروتونًا باستخدام زوج وحيد من الإلكترونات على ذرة O لربطها بـ H+ ينتج عن هذا تكوين أيونات الهيدرونيوم (H.).3ا+).
وفي الوقت نفسه لتفاعل تأين NH3 عندما يذوب في الماء ، NH3 بمثابة قاعدة و H.2يا كحمض.
نيو هامبشاير3(عبد القدير) + ح2O (ل) NH4+(عبد القدير) + أوه−(أنا)
نيو هامبشاير3 سيقبل بروتون (H+) من H.2O باستخدام زوج وحيد من الإلكترونات على ذرة N للترابط مع H+ ينتج عن هذا تكوين أيونات الأمونيوم (NH.).4+). ح2سوف يتحول O إلى أيونات OH− بعد التبرع بالبروتون (H+) ضد NH3.
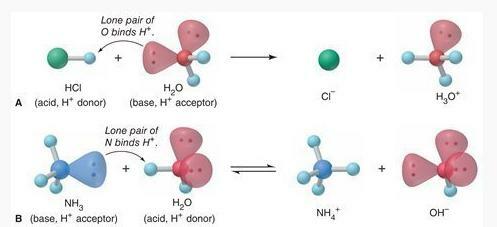
انحلال الحمض القاعدي في الماء كتفاعل Brnsted-Lowry الحمضي القاعدي (المصدر: Silberberg ، Martin S. وأماتيس ، باتريشيا. 2015. الكيمياء: الطبيعة الجزيئية للمادة والتغيير (الطبعة السابعة). نيويورك: McGraw-Hill Education)
من المثالين يتبين أن:
- يجب أن تحتوي الأحماض على ذرات هيدروجين يمكن إطلاقها على هيئة أيونات H.+.
- يجب أن تحتوي القواعد على زوج وحيد من الإلكترونات يمكنه الارتباط بأيونات H.+.
تتمثل ميزة تعريف Brønsted-Lowry في أنه يمكن أن يفسر التفاعلات الحمضية القاعدية في الأطوار الصلبة ، والغازية ، والسائلة ، والمحاليل مع المذيبات بخلاف الماء أو المخاليط غير المتجانسة.
مثال:
- التفاعل بين غاز NH3 (القاعدة) وغاز حمض الهيدروكلوريك (حمض) لتشكيل NH. دخان4Cl.
نيو هامبشاير3(ز) + حمض الهيدروكلوريك (ز) → NH4Cl (ق)
يمكن لبعض المواد أن تعمل كأحماض ، لكنها يمكن أن تعمل أيضًا كقواعد في تفاعلات أخرى ، على سبيل المثال H2أوه ، HCO3−، وكذلك H2ص4−. يشار إلى هذه المواد باسم amphiprotics.
مادة برمائية (مثل H2O) بمثابة حمض عند تفاعله مع مادة أساسية أكثر منه (على سبيل المثال NH3) ويعمل كقاعدة عند تفاعله مع مادة أكثر حمضية منه (مثل حمض الهيدروكلوريك).
2. نظرية قاعدة حمض أرهينيوس

تم طرح هذه النظرية في عام 1884 من قبل Svante August Arrhenius.
تعريف القاعدة الحمضية وفقًا لأرينيوس هو:
- الأحماض هي مركبات عندما تذوب في الماء تطلق H أيونات+.
- القاعدة عبارة عن مركب عندما يذوب في الماء يطلق أيونات OH−.
يصنف غاز حمض الهيدروكلوريك (HCl) شديد الذوبان في الماء على أنه حمض أرهينيوس ، كما هو الحال مع حمض الهيدروكلوريك الذي يمكن أن يتحلل إلى أيونات H.+ و Cl− في الماء.
على عكس حالة الميثان (CH4) وهو ليس حمض أرهينيوس لأنه لا يستطيع إنتاج أيونات H.+ في الماء على الرغم من احتوائه على ذرات H.
هيدروكسيد الصوديوم (NaOH) هو أيضًا قاعدة أرهينيوس ، حيث أن هيدروكسيد الصوديوم هو مركب أيوني يتفكك إلى أيونات الصوديوم.+ و OH− عندما يذوب في الماء.
يقتصر مفهوم حمض أرينيوس على حالة الماء كمذيب.
3. نظرية قاعدة حمض لويس

في عام 1923 ، أصدر ج. ن. طرح لويس (جيلبرت نيوتن لويس) نظرية أوسع للأحماض والقواعد من الاثنين النظرية السابقة من خلال التأكيد على أزواج الإلكترون المرتبطة بالهيكل و سند مالي.
تعريف لويس للقاعدة الحمضية هو:
- الأحماض هي متقبلات زوج الإلكترون.
- القواعد هي مانحة زوج الإلكترون.
انطلاقًا من هذا التعريف ، فإن الأحماض التي لها دور كأنواع متقبلة لزوج الإلكترون ليست فقط H+.
المركبات التي لها مدار فارغ في غلاف التكافؤ مثل BF3 يمكن أن يكون بمثابة حمض.
مثال:
التفاعل بين BF3 وكذلك NH3 هو تفاعل حمضي قاعدي ، حيث BF3 كحمض لويس و NH3 كقاعدة لويس.
نيو هامبشاير3 سوف تتبرع بزوج إلكترون إلى BF3 هذا يخلق رابطة تساهمية منسقة بين الاثنين.
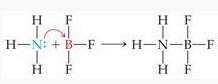
تتمثل ميزة تعريف لويس للقاعدة الحمضية في أنه يمكن أن يفسر التفاعلات الحمضية القاعدية الأخرى في وسط الغاز والصلب والمذيبات بخلاف الماء التي لا تتضمن نقل البروتون.
مثال:
- التفاعلات التي تحدث بين أكاسيد الحمض (مثل CO2 و حينئذ2) مع أكاسيد أساسية (مثل MgO و CaO).
- ردود الفعل لتكوين الأيونات المعقدة مثل [Fe (CN)6]3−، [آل (ح2س)6]3+، و [Cu (NH3)4]2+
- وبعض التفاعلات في الكيمياء العضوية.
خصائص قاعدة حمض الصفات
وفيما يلي بعض خصائص الأحماض والقواعد ومنها:
1. حامض
فيما يلي بعض خصائص الأحماض ، ومنها:
أ. طعم حامض نموذجي.
أكثر ما يميزه على أنه حمض هو وجود طعم حامض عندما يشعر به حاسة التذوق.
على سبيل المثال: الخل في الكيمياء يعرف الخل بحمض الخليك (حمض الإيثانويك).
ب. يمكن تغيير لون المؤشر.
يمكن تحديد الحموضة باستخدام المؤشرات. المؤشر الأكثر استخدامًا هو ورق عباد الشمس.
إذا كان المركب حمضيًا ، سيتحول ورق عباد الشمس الأزرق إلى اللون الأحمر ، بينما سيظل ورق عباد الشمس الأحمر أحمر.
ج. يتفاعل مع معادن معينة لإنتاج غاز H.2
المركبات الحمضية التي تتفاعل مع بعض المعادن تنتج غاز الهيدروجين.
أمثلة: معادن المغنيسيوم والنحاس والحديد والزنك.
ومع ذلك ، فإن نتيجة التفاعل الثاني ليست غاز الهيدروجين فحسب ، بل تحتوي أيضًا على مركبات ملح. فيما يلي مثال على رد الفعل:
حمض + معادن معينة + ملح + غاز الهيدروجين
إذا كنت تتفاعل بين حمضين مختلفين مع نفس المعدن ، فستفعل الحصول على نتائج مختلفة ، والعكس صحيح ، إذا تفاعلت مع معدنين بمركب حمضي نفسه.
هذا بسبب الاختلاف في قوة الحمض المستخدم.
د. يتفاعل مع القواعد لتكوين الملح والماء.
ه. يمكنه توصيل الكهرباء.
هذا لأن الأحماض يمكن أن تطلق الأيونات في المحلول. الأحماض القوية هي إلكتروليتات جيدة.
كلما كان الحمض أقوى ، كان توصيله الكهربائي أفضل (له خصائص إلكتروليتية جيدة).
مثال: حامض الكبريتيك في بطارية السيارة.
تحتوي المحاليل الحمضية على درجة حموضة أقل من 7 ، مع انخفاض قيمة الأس الهيدروجيني المقابلة لزيادة الحموضة.
F. أكسيد حامضي.
الأكاسيد الحمضية هي أكاسيد تنشأ من عناصر غير معدنية مع أكسجين.
مثال: CO2، وبالتالي2، ص2ا5، Cl2ا7 و اخرين. تنتج الأكاسيد الحمضية عند تفاعلها مع الماء محاليل حمضية.
الأكاسيد هي مركبات بين عناصر معينة والأكسجين.
2. لغة
وفيما يلي بعض خصائص القواعد ومنها:
أ. له طعم مر.
مركبات قلوية عند تذوقها باستخدام حاسة التذوق ، طعمها مر. على سبيل المثال ، عندما تأكل الصابون عن طريق الخطأ.
ب. تبدو اللغة زلقة.
على سبيل المثال ، عند الإمساك بالصابون ، سيكون الصابون زلقًا.
ج. عندما يذوب في الماء فإنه ينتج أيونات هيدروكسيد OH−
د. أكالة.
بعض المركبات الأساسية هي نوع من المركبات القاعدية القوية. القاعدة القوية لها خصائص أكالة بحيث يمكن أن تسبب تهيجًا أو حرقًا عند لمسها.
ه. يجري التيار الكهربائي.
تعتبر المركبات القلوية أيضًا موصلات جيدة للكهرباء ، خاصة للقواعد القوية. القواعد القوية تتأين بسهولة في الماء حتى تتمكن من توصيل الكهرباء.
F. يحيد الحموضة.
يمكن استخدام القواعد لتحييد الأحماض. تقلل المركبات الحمضية من حموضتها ، ويمكن أن تتحول إلى مواد غير حمضية عند تفاعلها مع القواعد.
تتفاعل الأحماض والقواعد لإنتاج الملح والماء. يُعرف هذا التفاعل باسم تفاعل التعادل.
مثال:
هيدروكسيد الكالسيوم + حامض الكبريتيك ← ملح كبريتات الكالسيوم + ماء
ز. لديه درجة حموضة تزيد عن 7.
كلما زادت قيمة الأس الهيدروجيني للمادة ، زادت درجة القلوية.
مثال على اللغة:
- الأمونيا لمذيب مطهر.
- صودا الخبز (هيدروكسيد الصوديوم) لتنظيف المصارف.
- هيدروكسيد الألومنيوم وهيدروكسيد المغنيسيوم لتسكين آلام المعدة.
ح. أكسيد أساسي
الأكاسيد الأساسية هي أكاسيد تنشأ من العناصر المعدنية مع الأكسجين.
مثال: Na2O ، CaO ، Fe2ا3، و اخرين. تتفاعل الأكاسيد الأساسية مع الماء لإنتاج المحاليل الأساسية.
من بين مركبات الأكسيد ، هناك ما يسمى أكسيد اللامبالاةوهي الأكاسيد التي لا يمكن أن تشكل أحماض أو قواعد. على سبيل المثال CO و NO. ليس هذا فقط ، فهناك أيضًا أكاسيد مذبذبة. يمكن أن يتفاعل مذبذب مع أيونات الحمض (H+) والأيونات الأساسية (OH–). مثال على أكسيد مذبذب هو Al2ا3 و ZnO.
تصنيف القاعدة الحمضية
تصنف الأحماض والقواعد حسب قوتها وتأينها وتنقسم إلى قسمين ، منها:
1. حمض قوي وقاعدة قوية
الأحماض القوية عبارة عن مركبات تتحلل تمامًا عند إذابتها في الماء وتنتج العدد الإجمالي للأيونات.
على سبيل المثال: HCL ، HNO3، H2SO4، HCIO4
القواعد القوية هي مركبات تتحلل تمامًا عند إذابتها في الماء.
أمثلة: NaOH ، KOH ، Ba (OH)2
2. حمض ضعيف وقاعدة ضعيفة
الأحماض الضعيفة عبارة عن مركبات تتحلل قليلاً عند إذابتها في الماء.
مثال: H3ص4، ح2وبالتالي3، HNO2، CH3COOH
القواعد الضعيفة عبارة عن مركبات لا تتحلل إلا قليلاً عند إذابتها في الماء.
مثال: NaHCO3، نيو هامبشاير4أوه
ثم بناءً على الشكل الأيوني ، يتم تصنيف الأحماض والقواعد إلى:
- حمض الأنيونيك هو حمض له شحنة سالبة. مثال: SO3–
- الحمض الكاتيوني هو حمض له شحنة موجبة. مثال: NN4+
- القواعد الأنيونية هي قواعد لها شحنة سالبة. مثال: CI–، CN–
- القاعدة الموجبة هي قاعدة لها شحنة موجبة. مثال: Na+، كاليفورنيا2+
مثال على المشاكل
فيما يلي مثال لمشكلة الحمض القاعدي وشرحها:
1. حدد الحمض والقاعدة في التفاعل الحمضي القاعدي التالي بإعطاء الأسباب بناءً على نظرية Brønsted-Lowry أو Arrhenius أو Lewis acid-base.
ني2+(عبد القدير) + 4CN−(aq) [Ni (CN)4]2−(أنا)
إجابه:
لا يمكن لنظرية أرهينيوس وكذلك نظرية برونستيد لوري تفسير رد الفعل أعلاه.
انطلاقا من نظرية لويس ، CN− هي قاعدة لويس ، لأنها تتبرع بزوج إلكترون لأيون النيكل2+ بحيث يتم تشكيل رابطة تساهمية منسقة ، بينما ني2+ هو حمض لويس ، لأنه يقبل زوج إلكترون من CN−.
